《化学反应热的计算》人教版高二化学选修4PPT课件(第一课时).pptx



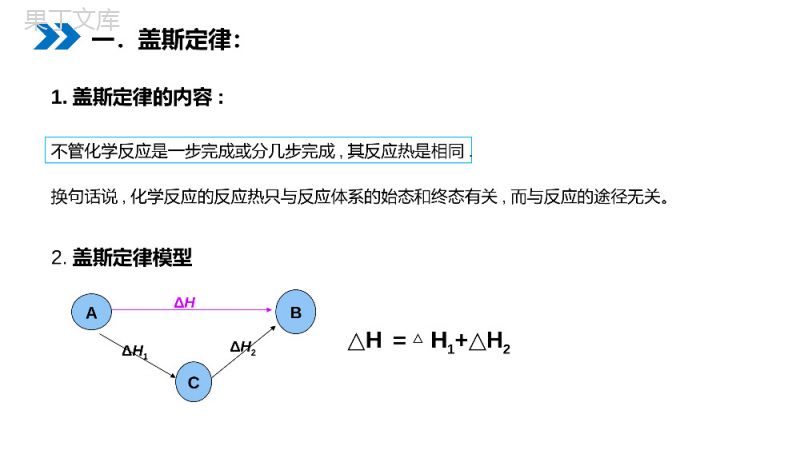
第一课时盖斯定律MENTALHEALTHCOUNSELINGPPT第3节化学反应热的计算第一章化学反应与能量人教版高中化学选修4(高二)1.如何测定③H2(g)+1/2O2(g)==H2O(l)的反应热△H根据下列反应计算已知①H2(g)+1/2O2(g)=H2O(g)H△1=-241.8kJ/mol②H2O(g)=H2O(l)H△2=-44kJ/mol解析:①+=②③△H=△H1+△H2=-285.8kJ/mol思考:已知①CO(g)+1/2O2(g)==CO2(g)ΔH2=-283.0kJ/mol②C(s)+O2(g)==CO2(g)ΔH3=-393.5kJ/mol解析:△H1=-②①所以,ΔH1=ΔH2-ΔH1=-393.5kJ/mol+283.0kJ/mol=-110.5kJ/mol2.如何测定C(s)+1/2O2(g)==CO(g)的反应热△H1根据下列反应计算思考:1.盖斯定律的内容:2.盖斯定律模型△H=△H1+H△2ΔHBACΔH1ΔH2不管化学反应是一步完成或分几步完成,其反应热是相同.换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。一.盖斯定律:一.盖斯定律:3.从能量守恒角度论证盖斯定律△H1+H△2≡0(终态)(始态)ABΔHCΔH1ΔH2ΔH+(-ΔH1)+(-ΔH2)≡0所以:ΔH=ΔH1+ΔH2一.盖斯定律:有些反应进行得很慢有些反应不容易直接发生有些反应的产品不纯(有副反应发生)……这些都给测量反应热造成了困难利用盖斯定律可以间接地把它们的反应热计算出来4、盖斯定律的应用有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。(2)若一个反应的焓变△H=aKJ/mol,则其逆反应的焓变△H=-aKJ/mol。利用已知反应的焓变求未知反应的焓变(1)若一个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的焓变亦可以由这几个反应的焓变相加减而得到;4、盖斯定律的应用已知:Zn(s)+1/2O①2(g)=ZnO(s)ΔH1=-351.1kJ/mol②Hg(l)+1/2O2(g)=HgO(s)ΔH2=-90.7kJ/mol则可知:③Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为多少?解析:①—②=③△H=△H1—H△2=-351.1kJ/mol-(-90.7kJ/mol)=-260.4kJ/mol练习(1)确定待求反应的热化学方程式。(2)找出待求热化学方程式中各物质出现在已知方程式中的位置(是同侧还是异侧)。(3)利用同侧相加、异侧相减进行处理。(4)根据待求方程式中各物质的化学计量数通过乘除来调整已知反应的化学计量数,并消去中间产物。(5)将调整后的化学方程式进行叠加并确定反应热的变化。加减消元法求未知反应焓变的方法2、根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:C(石墨)+O2(g)=CO2(g)△H=-393.5KJ/mol①2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol②2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2599.2KJ/mol③解析:(×4+-)÷2∵①②③得到2C(石墨)(s)+H2(g)=C2H2(g)∴△H=(△H1×4+△H2-△H3)÷2=+226.8KJ/mol2C(石墨)+H2(g)=C2H2(g)△H=+226.8KJ/mol练习3.写出石墨变成金刚石的热化学方程式(25,101kPa℃时)查P7燃烧热表可知:①C(石墨,s)+O2(g)=CO2(g)H△1=-393.5kJ/mol②C(金刚石,s)+O2(g)=CO2(g)H△2=-395.0kJ/mol①-②得:C(石墨,s)=C(金刚石,s)△H=H△1-H△2=-393.5kJ/mol-(-395.0kJ/mol)=+1.5kJ/mol练习4.某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:①N2(g)+2O2(g)=2NO2(g)H△1=+67.2kJ/mol②N2H4(g)+O2(g)=N2(g)+2H2O(l)H△2=-534kJ/mol假如都在相同状态下,请写出发射火箭反应的热化学方程式。2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol②×2—=H=2H①③△△2-H△1练习2SO2(g)+O2(g)2SO3(g)H=-197KJ/mol△若一密闭容器中通入2molSO2和1molO2,达平衡时,反应放热为Q1KJ,另一密闭容器中通入2molSO2和1.5molO2,达平衡时反应放热为Q2KJ,则()A.Q1<Q2<197B.Q2>Q1=197A二、可逆反应焓变5.已知25℃、101kPa条件下:(1)4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2834.9kJ·mol-1(2)4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3119.1kJ·mol-1由此得出的正确结论是()A.等质量的O2比O3能量低,由O2变为O3为吸热反应B.等质量的O2比O3能量高,由O2变为O3为放热反应C.O3比O2稳定,由O2变为O3为吸热反应D.O2比O3稳定,由O2变为O3为放热反应A练习6、已知25℃、101kPa时:4Fe(s)+3O2(g)==2Fe2O3(s)ΔH=-1648kJ·mol-1①C(s)+O2(g)==CO2(g)ΔH=-393kJ·mol-1②2Fe(s)+2C(s)+3O2(g)==2FeCO3(s)ΔH=-1480kJ·mol-1③FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______。解析:①×1/2+×2-②③==-1648×1/2+(-393)×2-(-1480)=-130kJ·mol-1答案:2FeCO3(s)+1/2O2(g)=Fe2O3(s)+CO2(g)ΔH=-130kJ·mol-1练习感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明第一课时盖斯定律MENTALHEALTHCOUNSELINGPPT感谢各位的仔细聆听第一章化学反应与能量人教版高中化学选修4(高二)
提供《化学反应热的计算》人教版高二化学选修4PPT课件(第一课时).pptx会员下载,编号:1701020846,格式为 xlsx,文件大小为18页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载