《原子结构与元素的性质》人教版高二化学上册选修三PPT课件(第1课时).pptx
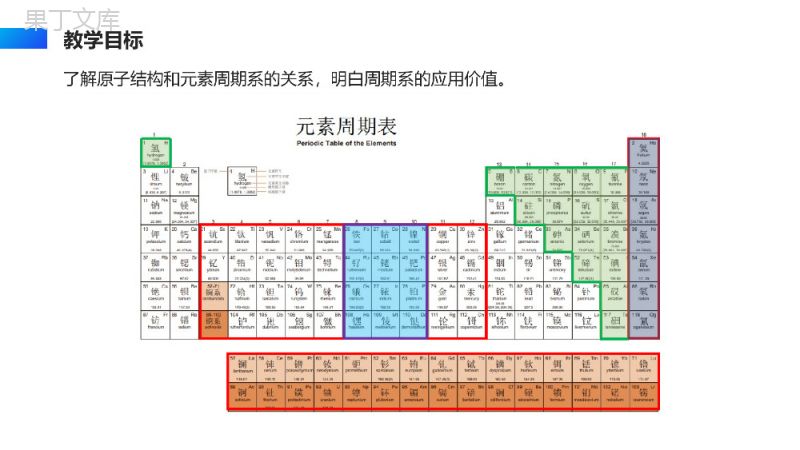
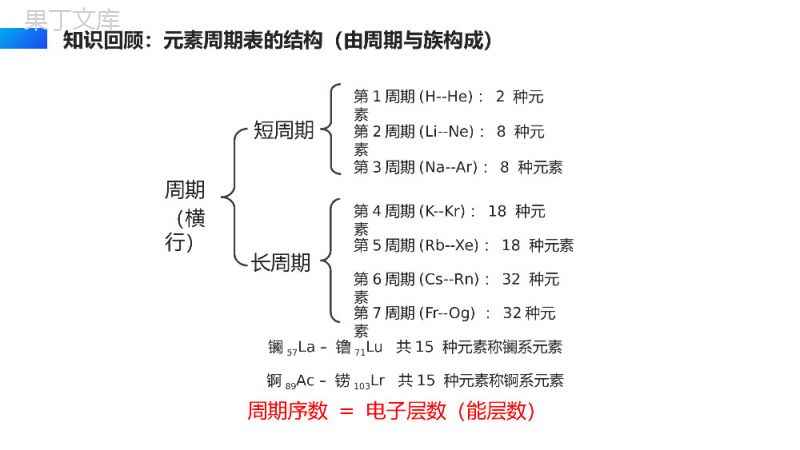

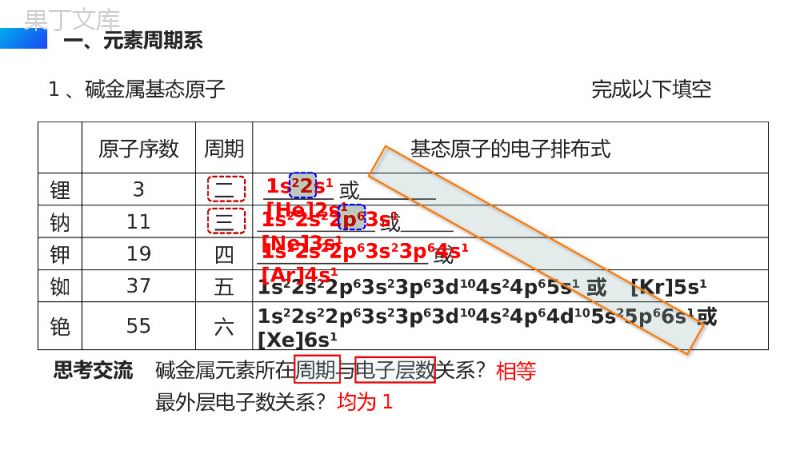
ATOMELEMENT原子结构与元素的性质ATOMICSTRUCTUREANDPROPERTIESOFELEMENTS高中化学必修三授课人:办公资源授课时间:20XX第二章第一节了解原子结构和元素周期系的关系,明白周期系的应用价值。教学目标周期短周期长周期第1周期(H--He):2种元素第2周期(Li--Ne):8种元素第3周期(Na--Ar):8种元素第4周期(K--Kr):18种元素第5周期(Rb--Xe):18种元素第6周期(Cs--Rn):32种元素第7周期(Fr--Og):32种元素镧57La–镥71Lu共15种元素称镧系元素锕89Ac–铹103Lr共15种元素称锕系元素周期序数=电子层数(能层数)(横行)知识回顾:元素周期表的结构(由周期与族构成)族主族:副族:ⅠA,ⅡA,ⅢA,ⅣA,ⅤA,ⅥA,ⅦA第VIII族:稀有气体元素主族序数=最外层电子数=价电子数=最高正价数(纵行)零族:共七个主族ⅠB,ⅡB,ⅢB,ⅣB,ⅤB,ⅥB,ⅦB共七个副族三个纵行(第8、9、10),位于ⅦB与ⅠB中间元素周期表从左到右族顺序依次为:ⅠA,ⅡA,ⅢB,ⅣB,ⅤB,ⅥB,ⅦB第VIII族;ⅠB,ⅡB,ⅢA,ⅣA,ⅤA,ⅥA,ⅦA,零族________________________________________________________知识回顾:元素周期表的结构(由周期与族构成)1、碱金属基态原子完成以下填空原子序数周期基态原子的电子排布式锂3二或钠11三或钾19四或铷37五1s22s22p63s23p63d104s24p65s1或[Kr]5s1铯55六1s22s22p63s23p63d104s24p64d105s25p66s1或[Xe]6s11s22s1[He]2s11s22s22p63s1[Ne]3s11s22s22p63s23p64s1[Ar]4s1思考交流碱金属元素所在周期与电子层数关系?相等最外层电子数关系?均为1一、元素周期系(1)周期系形成核电荷数递增碱金属稀有气体最外层电子数1—8,一个周期,循环往复。(2)形成原因核外电子排布的周期性变化2、周期系周期一二三四五六七元素数目28818183232随着核电荷数的递增,电子填充遵循构造原理,每一周期里元素数目随着周期序号的递增渐渐增多。元素周期系周期发展如同螺壳上的螺旋。1、周期与族(1)周期周期ⅠA零族能级组元素数目一1s11s21s2二[He]2s1[He]2s22p62s2p8三[Ne]3s1[Ne]3s23p63s3p8四[Ar]4s1[Ar]3d104s24p64s3d4p18五[Kr]5s1[Kr]4d105s25p65s4d5p18六[Xe]6s1[Xe]4f145d106s26p66s4f5d7p32七[Rn]7s1……32各周期均s轨道开始,以填充满p轨道告终。(除第一周期外)外围电子1—8周期数=电子层数二、原子结构与元素周期表(2)族表中有个纵列,三个纵列为第Ⅷ族,一般每个族序数和价电子数是的。(除稀有气体外)188.9.10相等二、原子结构与元素周期表主族元素价电子主族元素的最外层电子构型族数ⅠAⅡAⅢAⅣAⅤAⅥAⅦA最外层电子构型ns1ns2ns2np1ns2np2ns2np3ns2np4ns2np5零族元素价电子过渡元素价电子ⅠB~ⅡB族(n-1)d10ns1~2族序数=最外层电子数ns1~2或ns2np1~5族序数=价电子数ns2np6(He除外)ⅢB~ⅦB族(n-1)d1~5ns1~2族序数=价电子数副族元素处于金属元素向非金属元素过渡的区域,因此,又把副族元素称为过渡元素。族序数与价电子排布关系其排布式为[Ar]3d54s2,由于最高能级组数为4,其中有7个价电子,故该元素是第四周期ⅦB族。课堂练习已知某元素的原子序数是25,写出该元素原子的价电子层结构式,并指出该元素所属的周期和族。思考与探究按照电子排布,可把周期表的元素划分为5个区:s区、p区、d区、ds区、f区。划分区的依据是什么?s区、d区、p区分别有几个纵列?区的名称来自按照构造原理最后填充的能级的符号s区:特点:价电子数=主族序数=最外层电子数①并不是所有价电子层为ns1或2的元素都在S区,He除外(它在p区)注意:②除H外,都是金属元素含ⅠA与ⅡA共两族两列;价电子层为ns1或2(n≥1)p区:特点:①价电子总数=主族序数(零族除外)注意:He在p区,但它无p电子含ⅢA至ⅦA及零族共六族六列;价电子层为ns2np1-6(n≥2),②以非金属元素为主2、区的划分(1)依据电子排布d区:特点:②价电子总数=副族序数;若价电子总数为8、9、10,则为Ⅷ族。有元素在d区但并不符合(n-1)d1-9ns1-2规则,如:46Pd4d10。注意:①均为金属元素;含ⅢB至ⅦB和Ⅷ族共六族八列(镧系和锕系属f区);价电子层为(n-1)d1-9ns1-2①价电子总数=所在的列序数特点:②均为金属元素;且d轨道电子全充满,一般不参与化学键的形成。ds区:含ⅠB与ⅡB共两族两列;价电子层为(n-1)d10ns1或2包括镧系与锕系;价电子层(n-2)f0-14(n-1)d0-2ns2说明:由于最外层电子数基本相同,(n-1)d电子数也基本相同,一般是(n-2)f的电子数不同,因此镧系元素化学性质相似;锕系元素化学性质也相似。f区:非金属22种,金属与非金属交界线(梯形线)附近的非金属元素具有一定金属性,又称半金属或准金属,但不能叫两性非金属。位于右上角。注意s、d、ds区最外层电子数为1-2,反应易失,所以都是金属。(2)依据元素金属性与非金属性由于是ⅥA族,4d必是全充满的,所以价电子排布为5s25p4,电子排布式[Kr]4d105s25p4属P区1、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?课堂练习2、下列元素是主族元素还是副族元素?第几周期?第几族?(1)1s22s22p63s23p5(2)[Ar]3d104s13、由下列元素在周期表中的位置,给出其原子的价电子层构型(3)第四周期第VIA族(4)第四周期第IVB族P区,主族,第三周期,第VIIA族ds区,副族,第四周期,第IB族4S24P43d24S2感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明ATOMELEMENT谢谢各位同学观看倾听THANKYOUFORWATCHINGANDLISTENING高中化学必修三授课人:办公资源授课时间:20XX
提供《原子结构与元素的性质》人教版高二化学上册选修三PPT课件(第1课时).pptx会员下载,编号:1701021162,格式为 xlsx,文件大小为18页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载