实验粗食盐的提纯,粗食盐的提纯实验原理



实验粗食盐的提纯第1页,共19页。食用盐食盐主要来源于内陆矿盐,氯化钠含量须在97.5%以上。各种微量元素、防结块剂、功能物质、杂质等约2.5%。•防结块剂:磷酸钙•功能物质:氟化物、叶酸等•微量元素:铁、磷、碘•物理性质:无色透明的立方晶体,熔点为801℃,沸点为1413℃,相对密度为2.165。第2页,共19页。矿物盐晶体海盐晶体玻利维亚乌尤尼盐沼内的天然盐坨印度泰米尔纳德邦的盐田食盐易溶于水第3页,共19页。青海盐湖(海洋中提取的盐主要是工业用盐)第4页,共19页。实验目的2.学习蒸发浓缩、倾析法常压过滤、减压抽滤等基本操作。1.通过粗食盐的提纯,了解盐类溶解度知识及沉淀溶解平衡原理的应用。3.掌握定性检查产品纯度的方法。第5页,共19页。实验原理:比较食盐与五水硫酸铜的提纯方法粗食盐中的杂质不溶性:泥沙、悬浮物等(过滤除去)可溶性:Ca2+、Mg2+、K+、SO42-等(化学法除去)Ba2++SO42-=BaSO4↓加入BaCl2:加入Na2CO3:Ba2++CO32-=BaCO3↓Ca2++CO32-=CaCO3↓2Mg2++2CO32-+H2O=[Mg2(OH)2]CO3↓+CO2↑加入HCl:CO32-+2H+=H2O+CO2↑加入顺序是否可以改变?第6页,共19页。仪器试剂仪器:百分之一电子天平,烧杯,量筒,普通漏斗,漏斗架,布氏漏斗,抽滤瓶,蒸发皿,石棉网,酒精灯,药匙。试剂:粗食盐,HCl(2mol·L-1),NaOH(1mol·L-1),BaCl2(1mol·L-1),Na2CO3(1mol·L-1),(NH4)2C2O4(0.5mol·L-1),6mol·L-1HAc镁试剂,滤纸,pH试纸。第7页,共19页。用小烧杯称取5g粗食盐,加蒸馏水25mL,搅拌并加热使其溶解。1、粗盐的提纯实验步骤(1)粗盐的溶解生成沉淀:微沸、边搅拌边逐滴加入1mol·L-1BaCl2溶液1~2mL至沉淀完全。SO42-检验:静置分层、以BaCl2检验沉淀是否完全。陈化、过滤:沉淀完全后,继续加热2~3min,冷却后用倾析法过滤(少量水洗)。①除去SO42-(2)化学处理(沉淀剂加入原则)第8页,共19页。②除去Ca2+、Mg2+和Ba2+沉淀:将①中的滤液加热至沸腾,小火微沸,边搅拌边滴加1mol·L-1Na2CO3溶液至沉淀完全(适当补充蒸馏水)。检验:静置分层、以Na2CO3检验沉淀是否完全。陈化、过滤:同①。(少量水洗)③除去CO32-往②的滤液中滴加2mol·L-1HCl,剧烈搅拌,调至pH=2~3。将滤液倒入蒸发皿中,微火蒸发使CO32-转化为CO2逸出。第9页,共19页。将晶体移入蒸发皿中,在石棉网上用小火烘炒,用玻璃棒不断翻动,以防结块,至无水蒸气逸出后,即得到洁白、松散的NaCl晶体,冷却至室温,在百分之一电子天平上称量,计算产率。(3)蒸发、浓缩将用盐酸处理过的溶液蒸发,当液面出现晶体时,改用小火不断搅拌,以免溶液溅出。当溶液蒸发至稀糊状时(切勿蒸干!)停止加热,取下冷却,减压过滤,尽可能将NaCl晶体抽干(滤纸不润洗,布氏漏斗的使用)。(4)干燥第10页,共19页。第11页,共19页。固液分离技术——常压过滤第12页,共19页。固液分离技术——减压过滤第13页,共19页。取0.5g提纯前和提纯后的食盐,分别用5mL蒸馏水溶解,然后各盛于3支试管中,组成3组,对照实验它们的纯度。2、产品纯度的检验在第一组溶液中分别加入2滴1mol·L-1BaCl2,比较沉淀产生的情况。(1)SO42-的检验第14页,共19页。在第三组溶液中各加入2~3滴1mol·L-1NaOH溶液,使溶液呈碱性(用pH试纸检验),再各加入2~3滴镁试剂,观察有无蓝色沉淀产生。(2)Ca2+的检验在第二组溶液中分别加入2滴0.5mol·L-1(NH4)2C2O4溶液和2滴6mol·L-1HAc,观察试管中是否有沉淀产生。(3)Mg2+的检验第15页,共19页。总的实验流程粗盐5.0g称量加水25mL,搅拌溶解常压过滤,滴加BaCl2至沉淀完全除SO42-弃去BaSO4抽滤,在蒸发皿中小火干燥抽滤、干燥精盐产品纯度检验弃去含K+母液计算产率称重粗、精盐对比滤液常压过滤,滴加Na2CO3至沉淀完全除Ca2+、Mg2+、Ba2+滤液滴入盐酸至pH2-3除CO32-蒸发、浓缩蒸浓至稀浆状稠液弃去Mg(OH)2、CaCO3、BaCO4冷至室温第16页,共19页。1.粗食颗粒要研细,溶解的水不能过多。2.沉淀剂不宜加入过多,适当过量即可。3.食盐溶液浓缩时切不可蒸干,稀糊状即可。5.产品食盐尽量抽干。注意事项第17页,共19页。1.加入25mL水溶解5g食盐的依据是什么?加水过多或过少有什么影响?问题讨论2.怎样除去实验过程中所加的过量沉淀剂BaCl2,和Na2CO3?答:依据食盐在沸点下的溶解度。加水过多不利于离子的沉淀完全;加水过少粗食盐可能溶不完。答:BaCl2用Na2CO3;Na2CO3用HCl。第18页,共19页。3.提纯后的食盐溶液浓缩时为什么不能蒸干?5.在粗食盐的提纯中,①②两步,能否合并过滤?4.在检验SO42-时,为什么要加入盐酸溶液?答:不能。因为在②加入Na2CO3后,会有少量①中的BaSO4转化为BaCO3,从而又释放出少量SO42-。答:少量溶液的存在用于溶解KCl,否则KCl也会析出。答:因为BaCO3也是白色沉淀,但它可溶于HCl。第19页,共19页。
提供实验粗食盐的提纯,粗食盐的提纯实验原理会员下载,编号:1701027243,格式为 xlsx,文件大小为19页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载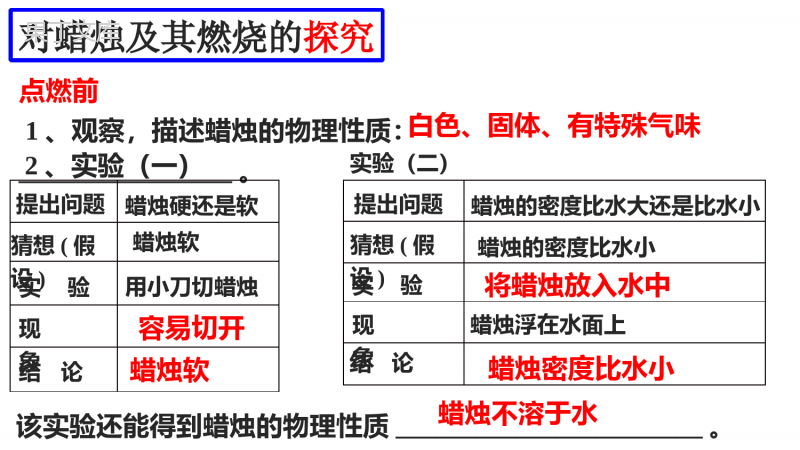 下载
下载