初三上学期化学原子的构成课件



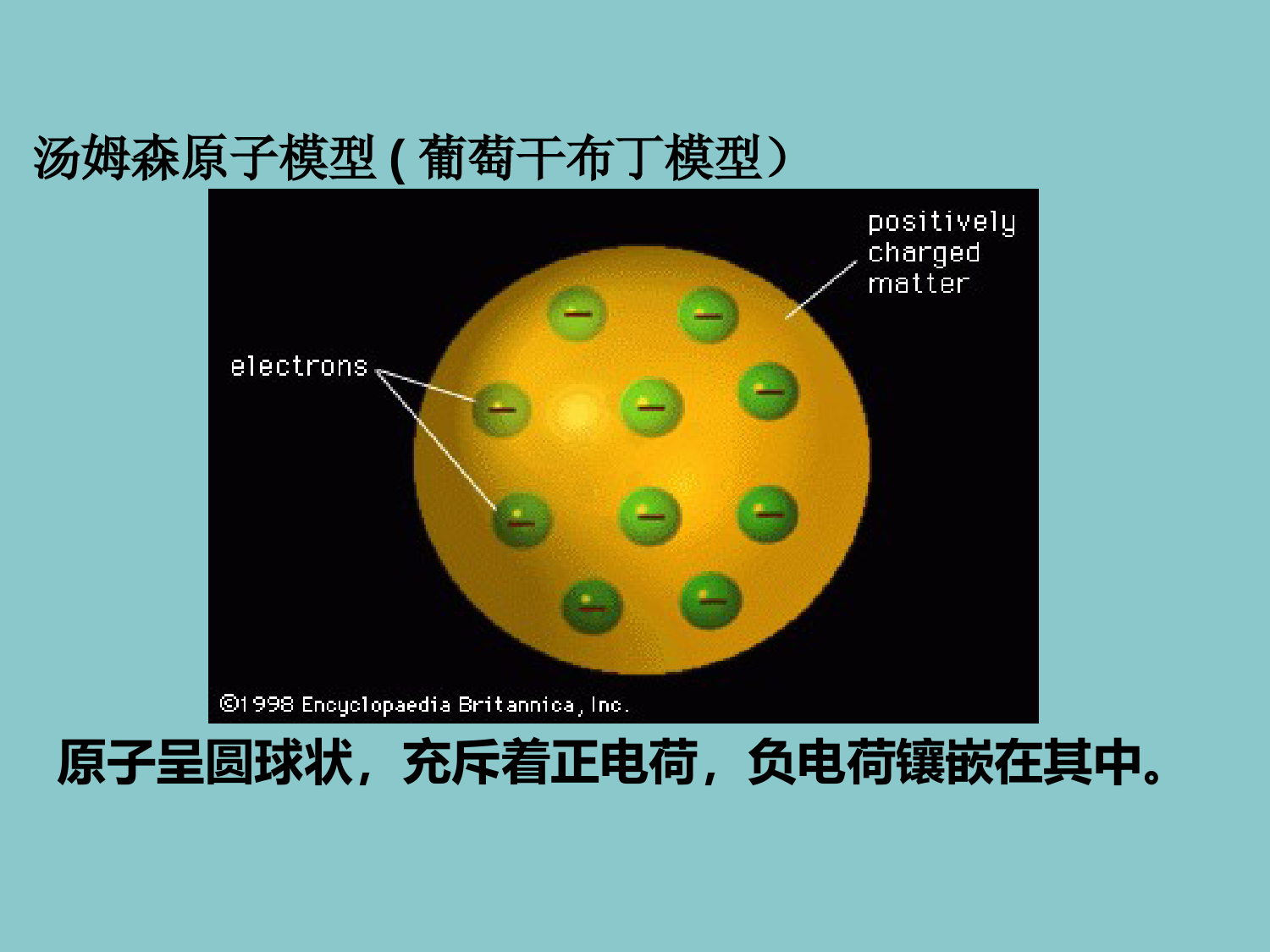
第三节原子的构成近代科学家道尔顿在他的原子学说中,认为原子是密不可分的实心球体。道尔顿前人足迹1897年汤姆森在原子中发现了,那么原子是可分的。电子带负电一、原子的结构汤姆森+++++-----踏上旅程--------原子中能不能只含带负电的电子?(原子不显电性)汤姆森原子模型(葡萄干布丁模型)原子呈圆球状,充斥着正电荷,负电荷镶嵌在其中。探究活动α粒子散射实验α粒子:①带正电②是电子质量的7344倍操作:用一束高速的α粒子轰击金箔紧追不舍猜想:所有α粒子毫不费力击穿金原子原子带正电的粒子粒子束α原子α粒子是带正电、质量比电子大的多的微粒粒子束α卢瑟福α粒子散射实验α粒子是带正电的质量比电子大的多1、大多数α粒子顺利穿透金箔2、一小部分α粒子改变原来的方向原子核体积很小原子核带正电3、极少数α粒子被反弹回来原子核的质量比α粒子大得多假如当时你在现场,你能试着对上述现象加以解释吗?你知道原子核到底有多大吗?万人体育场如同:原子蚂蚁原子核在1911年卢瑟福提出:原子有核模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。一、原子的结构原子原子核(带正电)核外电子(带负电)原子弹是利用原子核裂变瞬间释放巨大能量而发生爆炸的。原子的构成:1个电子带一个单位负电荷质子中子1个质子带一个单位正电荷中子不带电在原子中:核电荷数=核内质子数=核外电子数原子原子核外电子原子核核外电子原子核粒子种类质量(kg)质子=1.6726×10-27中子=1.6749×10-27电子=质子质量的1/1836观察表格,你得到什么启示?原子的质量几乎全部集中在原子核上,核外电子的质量忽略不计。观察表格,你发现了哪些规律?课本P38你能得出的信息有:1.不是所有的原子都有中子2.质子数不一定等于中子数3.质子数等于核外电子数4.不同种类的原子,核内质子数不同原子种类符号质子数中子数核外电子数氢H101氧O888钠Na111211氯Cl171817碳-12C-12666碳-13C-13676碳-14C-146861、有关原子的叙述错误的是()A原子由原子核和核外电子构成B原子的核电荷数等于核外电子数C原子中电子的质量可以忽略不计D原子由质子和中子构成2、原子是构成物质的基本粒子下列有关原子的叙述,错误的是()A原子的质子数等于核电荷数B原子的质量主要集中在原子核上C原子在化学变化中能够再分D原子可以构成分子基础测试DC分子H2H2OCO2物质氢气水固态二氧化碳有些物质由分子构成由原子直接构成的物质:(2)固态非金属(1)金属金刚石金铜原子具有微观粒子的基本性质:1、原子质量和体积小3、原子之间存在间隔和相互作用2、总在不断运动能力提升1、下列叙述正确的是()A原子核都由质子和中子构成B在原子中,核内的质子数与核外的电子数不一定相等C原子里有相对很大的空间,电子在这个空间里作高速运动D不同种类的原子,核内的质子数不同,核外电子数可以不等于质子数C2、有关原子的说法正确的是()A原子能构成分子,但不能直接构成物质。B原子在化学变化中不能再分,只能重新组合。C碳12原子核碳13原子的中子数相同。D原子中一定含有质子、中子、电子三种粒子。B4、在分子、原子、质子、中子、电子中,找出符合条件的粒子,填在相应的横线上。⑴带正电荷的粒子是;⑵质量最小的粒子是;⑶不显电性的粒子是;⑷在同一原子中数目相等的是;⑸化学变化中的最小粒子是;⑹能保持物质化学性质的粒子是。质子电子分子、原子、中子质子、电子原子分子、原子原子原子核(带正电)核外电子(带负电)质子(带正电)中子(不带电)不显电性核电荷数=核内质子数=核外电子数说收获一、原子的结构二、原子的特点1、原子质量和体积小2、原子之间存在间隔和相互作用3、总在不断运动
提供初三上学期化学原子的构成课件会员下载,编号:1701027743,格式为 xlsx,文件大小为23页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载