《分子晶体与原子晶体》高二上册化学选修三PPT课件(第1课时).pptx

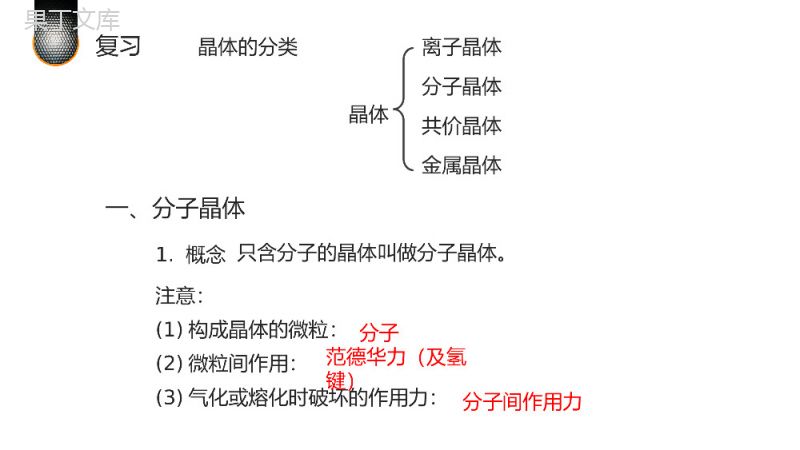



晶体结构与性质分子晶体与共价晶体20XX.XX.XXMOLECULARCRYSTALANDCOVALENTCRYSTAL授课人:办公资源高中化学选修三01复习晶体的分类晶体离子晶体分子晶体共价晶体金属晶体1.概念注意:(1)构成晶体的微粒:(2)微粒间作用:(3)气化或熔化时破坏的作用力:分子范德华力(及氢键)分子间作用力只含分子的晶体叫做分子晶体。一、分子晶体(1)较低的熔点和沸点,易升华;(3)一般都是绝缘体,熔融状态也不导电。有些在水溶液中可以导电.(2)较小的硬度注:①分子间作用力越大,熔沸点越高(相对分子质量,分子极性,氢键)②分子晶体熔化时一般只破坏分子间作用力,不破坏化学键。(4)溶解性:有相似相溶规律。2、物理特性:(1)所有非金属氢化物:H2O,H2S,NH3,CH4,HX(2)部分非金属单质:X2,O2,H2,S8,P4,C60(3)部分非金属氧化物:CO2,SO2,NO2,P4O6,P4O10(4)几乎所有的酸:H2SO4,HNO3,H3PO4(5)绝大多数有机物的晶体:乙醇,冰醋酸,蔗糖3、典型的分子晶体:大多数分子晶体的结构特点:分子的密堆积(与每个分子距离最近的相同分子共有12个)4.结构特征(与CO2分子距离最近的CO2分子共有12个)干冰的晶体结构图(1)CO2分子的分子密堆积(2)分子非密堆积——分子间作用力主要是氢键(氢键有方向性),如:冰。7当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小(m=ρv)。氢键具有方向性氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。分子晶体与原子晶体的比较晶体类型分子晶体原子晶体定义分子间通过分子间作用力结合形成的晶体相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体组成微粒分子原子课堂互动讲练晶体类型分子晶体原子晶体物质类别多数的非金属单质和共价化合物金刚石、晶体硅、碳化硅、二氧化硅等少数非金属单质及共价化合物微粒间的作用力分子间作用力(氢键、范德华力)共价键(极性键、非极性键)熔化时需克服的作用力较弱的分子间作用力很强的共价键课堂互动讲练晶体类型分子晶体原子晶体典型例子(1)干冰①每个晶胞中有4个CO2分子,12个原子。②每个CO2分子周围等距离紧邻的CO2分子有12个。(1)金刚石①在晶体中每个碳原子以4个共价键对称地与相邻的4个碳原子相结合,形成正四面体结构。②晶体中C—C—C夹角为109°28′,碳原子采取了sp3杂化。③最小环上有6个碳原子。④晶体中C原子个数与C—C键数之比为1∶(4×)=1∶2。12课堂互动讲练12晶体类型分子晶体原子晶体典型例子(2)冰①水分子之间的作用力有范德华力,但主要作用力是氢键。②由于氢键的存在迫使在四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。(2)二氧化硅①在晶体中每个硅原子和4个氧原子形成4个共价键;每个氧原子与2个硅原子相结合。故SiO2晶体中硅原子与氧原子按1∶2的比例组成。②最小环上有12个原子。课堂互动讲练科学视野天然气水合物——一种潜在的能源1.分子晶体:由分子构成。相邻分子靠分子间作用力相互吸引。2.分子晶体特点:低熔沸点、升华、硬度很小等。3.常见分子晶体分类:(1)所有非金属氢化物(2)部分非金属单质(3)部分非金属氧化物(4)几乎所有的酸(而碱和盐则是离子晶体)(5)绝大多数有机物的晶体。4.分子晶体结构特征(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰、I2、O2)(2)有分子间氢键-不具有分子密堆积特征(如:HF、冰、NH3)小结1.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是()A.干冰B.氯化钠C.氢氧化钠D.碘2.下列有关分子晶体熔点的高低叙述中,正确的是()A、Cl2>I2B、SiCl4>CCl4C、NH3
提供《分子晶体与原子晶体》高二上册化学选修三PPT课件(第1课时).pptx会员下载,编号:1701020903,格式为 xlsx,文件大小为17页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载