课题3-溶液的浓度-2022-2023学年九年级化学下册系列教学课件(人教版)



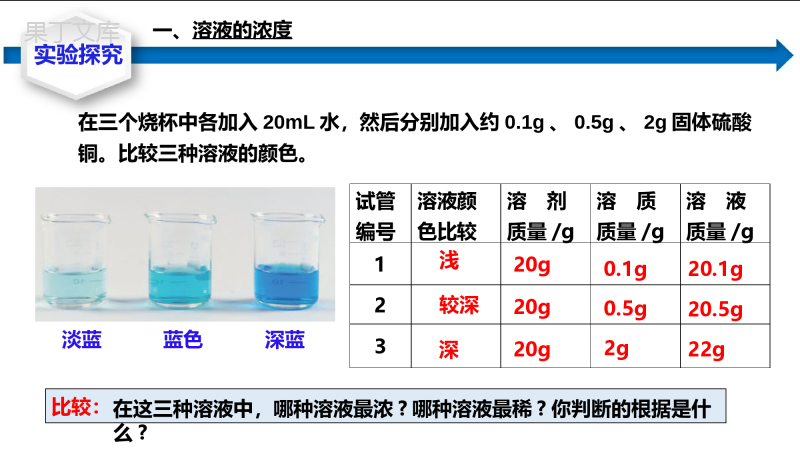

课题3溶液的浓度第九单元010203掌握一种溶液组成的表示方法——溶质的质量分数,并能进行溶质质量分数的简单计算。掌握溶液稀释的方法和计算。掌握有关化学反应方程式与溶质质量分数相结合的计算。教学目标引入新课溶液浓度常用的表示方法体积分数:V/V质量浓度:mg/L质量分数:m/m实验探究在三个烧杯中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。淡蓝蓝色深蓝试管编号溶液颜色比较溶剂质量/g溶质质量/g溶液质量/g123浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g在这三种溶液中,哪种溶液最浓?哪种溶液最稀?你判断的根据是什么?比较:一、溶液的浓度提出问题把种子放在一定浓度的食盐水中,饱满的种子会沉下去,而干瘪的由于食盐水的浮力会漂浮。溶质的质量溶液的质量×100%溶质的质量溶质质量+溶剂质量×100%溶质的质量分数农业生产中用食盐水选种原理:食盐水选种二、溶质的质量分数试管编号溶液颜色比较溶剂质量/g溶质质量/g溶液质量/g溶质质量分数123浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g0.5%2.4%9.0%在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。计算并比较三种溶液的溶质质量分数。实验对比二、溶质的质量分数结论:溶液中溶质的质量分数越大,溶液浓度越大结论:饱和溶液的溶质质量分数=×100%溶解度100g+溶解度溶质质量/g溶剂质量/g溶液质量/g3610013636g136g100%×=26.5%已知200C时,氯化钠的溶解度是36g“。有人说:200C时氯化钠饱和溶液中溶质的质量分数为36%”。这种说法对吗?为什么?质量分数——根据溶解度计算饱和溶液的质量分数新知探究1234溶质的质量是指被溶解的那部分溶质,未溶解的溶质不应考虑。(计算饱和溶液溶质质量时要考虑溶解度)溶液的质量包括溶液中所有溶质的质量。计算时上下质量单位要统一;不要忘记X100%,最后得到百分数。饱和溶液的溶质质量分数=×100%溶解度100g+溶解度知识点拨二、溶质的质量分数【例题1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?新知探究三、溶质质量分数的计算任务1:计算溶质和溶剂的量【解】溶质的质量分数溶质质量溶液质量100%溶质质量溶液质量×溶质的质量分数答:配制150kg质量分数为16%的氯化钠溶液需24kg氯化钠和126kg水。溶剂质量溶液质量溶质质量—150kg16%24kg150kg24kg126kg1.某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。2.配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水的质量各是多少?2.溶液质量=溶液体积×溶液密度=500mL×1.1g/cm3=550g溶质质量=550g×10%=55g溶剂质量=550g—55g=495g答:需要氢氧化钠55g,水495g。【解】1.溶质的质量分数=×100%=20%7g35g答:该溶液中溶质的质量分数为20%课堂提升三、溶质质量分数的计算【例题2】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?新知探究三、溶质质量分数的计算注意:溶液稀释前后,溶质的质量不变【解】设:稀释后溶液的质量为X。50g×98%=X×20%=245g需要水的质量=245g-50g=195g答:需要水的质量为195g。X=50g×98%20%任务2:溶液的稀释计算练习1:把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是多少?【解】设:稀释后溶液的质量为X。100g×98%=X×10%X=980g需要水的质量=980g-100g=880g答:需要水的质量为880g。三、溶质质量分数的计算新知探究【例题3】100g某硫酸溶液恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。任务3.把溶质的质量分数运用于化学方程式的计算三、溶质质量分数的计算注意:参加反应的是溶液中的溶质【解】:设这种硫酸中溶质的质量为XZn+H2SO4=ZnSO4+H2↑659813gX13gX6598X==19.6g98×13g65溶质的质量分数=×100%=19.6%19.6g100g答:这种硫酸溶液中溶质的质量分数为19.6%。新知探究练习1:73g质量分数为20%的盐酸与足量大理石反应,生成二氧化碳的质量是多少?这些二氧化碳的体积(标准状况)是多少?(在标准状况下,CO2的密度为1.977g/L。)三、溶质质量分数的计算【解】:盐酸中溶质的质量为:73g×20%=14.6gCaCO3+2HCl=CaCl2+CO2↑+H2O设生成二氧化碳的质量为X734414.6gX7314.6g44X=X=8.8g二氧化碳的体积=8.8g÷1.977g/L=4.5L答:CO2的质量为8.8g;CO2的体积为新知探究巩固提升实验室用100g稀硫酸和多少g锌恰好完全反应可制得0.8g氢气。H2SO4+Zn=ZnSO4+H2↑9865100gXA解:设所需锌的质量为XX65100g98X=66.3gH2SO4+Zn=ZnSO4+H2↑652X0.8gB解:设所需锌的质量为X0.8g2x65X=26g下面哪种解法正确?X65100g980.8g2x65课堂总结溶液的浓度溶质的质量分数溶液的质量分数的计算1.求溶质溶剂2.稀释问题计算3.具体应用计算1.溶质的质量是指被溶解的那部分溶质,未溶解的溶质不应考虑。2.溶液的质量包括溶液中所有溶质的质量。3.饱和溶液的溶质质量分数=×100%溶解度100g+溶解度1.已知KNO3的溶解度随温度的升高而增大。下列各图是某KNO3饱和溶液的浓度随温度升高而变化的图像(不考虑溶剂的质量变化),其中正确的是()C课堂练习2.硫酸钠是一种重要的化工原料,其溶解度曲线如图所示。下列说法正确的是()A.硫酸钠的溶解度随温度升高而增大B.30℃时硫酸钠饱和溶液的质量分数为40%C.40℃时硫酸钠的溶解度为50gD.50℃时硫酸钠饱和溶液降温后一定饱和C课堂练习3.6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:稀硫酸中溶质的质量分数?解:设稀硫酸中溶质的质量为X,Zn+H2SO4=ZnSO4+H2↑65986.5gX稀硫酸中溶质的质量分数:9.8g/100g×100%=9.8%答:稀硫酸中溶质的质量分数为9.8%65986.5gX=X=9.8g课堂练习4.26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:黄铜中铜的质量分数?解:氢气的质量为100g+26g—125.8g=0.2克。设锌的质量为X,Zn+H2SO4=ZnSO4+H2↑652X0.2g黄铜中铜的质量分数:(26g-6.5g)/26g×100%=75%答:黄铜中铜的质量分数为75%652X0.2g=X=6.5g课堂练习再见
提供课题3-溶液的浓度-2022-2023学年九年级化学下册系列教学课件(人教版)会员下载,编号:1701029602,格式为 xlsx,文件大小为21页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载