-鲁教版(五四制)化学九年级全一册-第一单元-溶液-复习(课件)

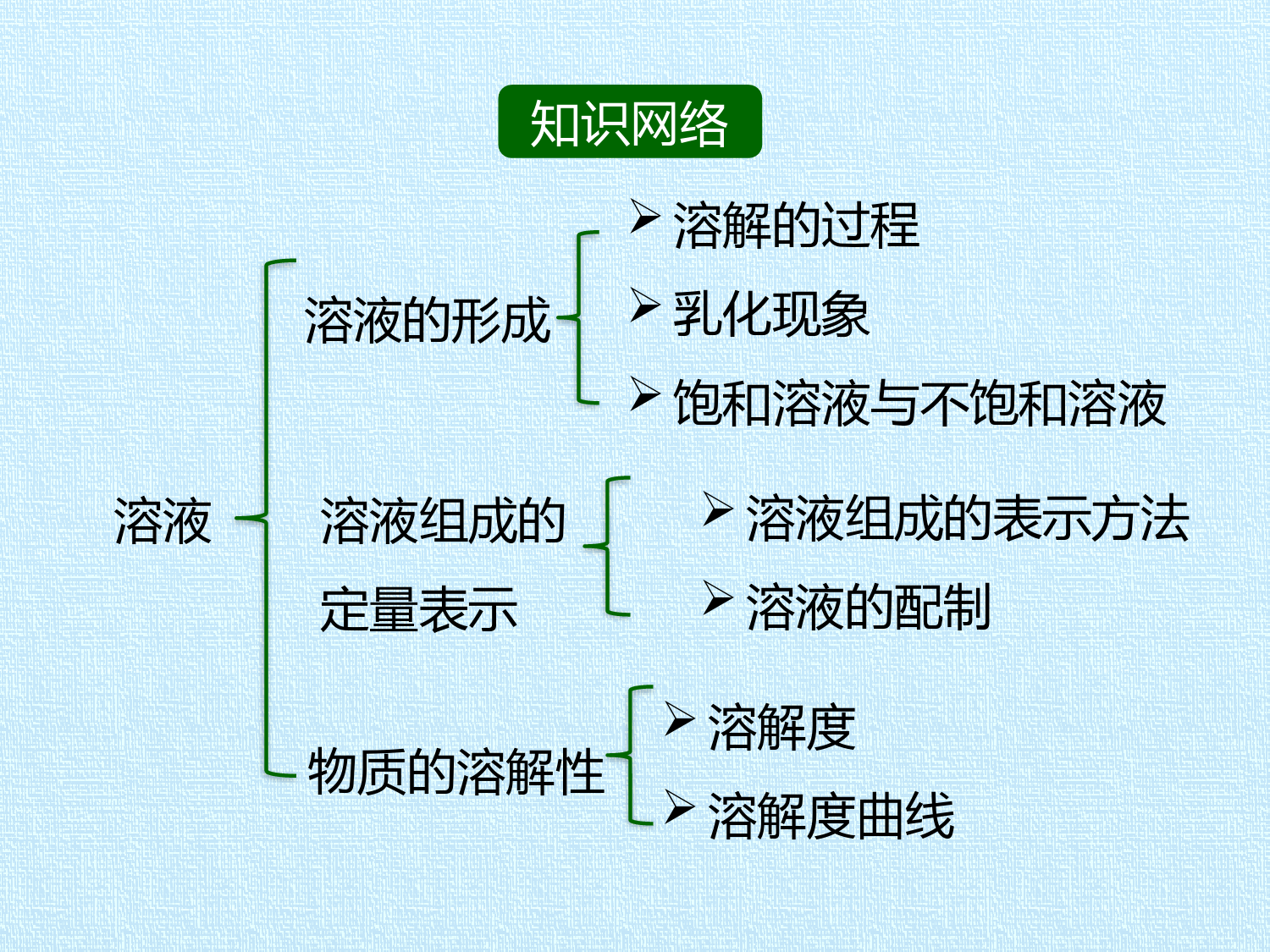



第1单元溶液复习课件知识网络溶液溶液的形成溶解的过程乳化现象饱和溶液与不饱和溶液溶液组成的表示方法溶液的配制溶液组成的定量表示物质的溶解性溶解度溶解度曲线知识回顾1.溶液(1)一种或几种物质分散到另一种物质里,形成的_______、_______的混合物。(2)基本特征:________、________、________。(3)溶质:_______的物质。(4)溶剂:起_________的物质,水是最常见的溶剂。知识点1溶液的形成均一稳定溶解作用被溶解均一性稳定性混合物2.物质溶解时温度的变化(1)物质溶解于水的过程中发生了两种变化:一是溶质的分子(或离子)向水中扩散,这一过程_____热量;二是溶质的分子(或离子)和水分子作用,生成水和分子(或水合离子),这一过程_____热量。(2)若吸热<放热,溶液温度_______;若吸热=放热,溶液温度不变;若吸热>放热,溶液温度_______。吸收升高降低放出3.乳化现象:(1)含表面活性剂的物质可以使食用油等物质以____________均匀分散在水中,形成不易分层、比较稳定的混合物,这种现象叫做___________。(2)乳化作用在生产生活中应用广泛,如利用__________可以轻松去除衣物或餐具上的油污。细小的液滴乳化现象洗涤剂4.饱和溶液与不饱和溶液(1)饱和溶液:在__________下,在_______的溶剂里,_____再继续溶解某种溶质的溶液就是该溶质的饱和溶液。(2)不饱和溶液:在__________下,在_______的溶剂里,___再继续溶解某种溶质的溶液就是该溶质的不饱和溶液。(3)饱和溶液与不饱和溶液的相互转化饱和溶液增加溶剂,减少溶质,改变温度增加溶质,减少溶剂,改变温度不饱和溶液一定温度一定量不能一定温度一定量能知识点2溶液组成的定量表示1.溶质质量分数(1)定义:_____的质量与_____的质量的比值。(2)(3)溶液的质量=_____的质量+_____的质量。(4)溶液稀释的计算依据:溶液稀释前后______的质量不变。溶质的质量溶液的质量×100%溶质溶液溶质溶剂溶质质量分数=溶质2.溶液的配制步骤:(1)计算:按配制要求计算出所需要的___________的量(固体计算出质量,液体计算出体积);(2)_____:称量或量取所要用的实验药品;(3)_____:把溶质和溶剂混合,搅拌至充分溶解即可;(4)装瓶存放:把配好的溶液装入_______中,贴上标签。溶质和溶剂称量溶解试剂瓶知识回顾1.溶解度概念:在____________下,某固态物质在______g溶剂里达到________状态时所溶解的________,叫做这种物质在这种溶剂里的溶解度。2.固体物质溶解度“四要素”。①条件:_________;②标准:100g_____;③状态:达到_________;④实质:_____的质量,单位一般是___。知识点3物质的溶解性一定温度100饱和质量一定温度溶剂饱和状态溶质克3.影响因素:(1)内因:溶质和溶剂的性质;(2)外因:主要是________。①多数物质的溶解度随温度的升高而增大,如______;②少数物质的溶解度受温度的影响很小,如________;③极少数物质的溶解度随温度的升高而减小,如________。温度KNO3NaClCa(OH)2【注意】(1)物质溶解度大小与溶质质量、溶剂质量的多少无关,在一定温度下,某物质的溶解度是一个定值。(2)判断某一数值是不是溶解度,关键是看它是否同时满足四个条件“一定温度、100g溶剂、饱和状态、溶解的溶质质量”。(3)只有在饱和溶液中才存在如下关系:溶解度/100g=溶质质量/溶剂质量;溶解度/(溶解度+100)g=溶质质量/溶液质量。4.溶解度曲线(1)概念:指溶解度随温度变化的曲线。横坐标表示________,纵坐标表示__________。(3)含义:①曲线上的点,表示某物质的饱和溶液;②曲线的走向表示某物质的溶解度随温度的变化情况;③两条溶解度曲线的交点表示两种溶质在某一温度下的溶解度相同。温度溶解度5.结晶(1)定义:固体物质从它的______溶液中以______的形式析出的过程叫做结晶。(2)物质结晶的方法①__________(又叫冷却热饱和溶液法):适用于溶解度随温度变化较大的物质,如KNO3。②__________(蒸发溶剂法):适用于溶解度随温度变化较小的物质,如NaCl。③__________:适用于溶解度随温度的升高而变小的物质,如Ca(OH)2。饱和晶体降温结晶蒸发结晶升温结晶例题解析命题角度:考查学生对溶液的掌握情况。例1下列关于溶液的说法中正确的是()A.溶液都是无色透明的混合物B.碘酒溶液中酒精是溶质C.饱和溶液降温后,都有溶质结晶析出D.溶质以分子或离子的形式均匀分散在溶剂中►类型一溶液的综合判断D【解析】A.溶液不一定都是无色的,如硫酸铜溶液就是蓝色的,错误;B.碘酒溶液中,碘是溶质,酒精是溶液,错误;C.饱和溶液降温后,不一定有溶质结晶析出,如氢氧化钙的溶解度随温度的升高而减小,降温反而使其饱和溶液变为不饱和溶液,错误;D.溶液具有均一性,就是因为溶液中的溶质以分子或离子的形式均匀分散在溶剂中,正确。故选:D。【变式题】溶液在日常生活中应用广泛。下列对溶液的有关说法正确的是()A.溶液都是无色、透明的液体B.溶液中只能有一种溶质C.溶液中各部分密度不同D.溶液中各部分性质相同D【解析】本题考查学生对溶液的理解能力。溶液指的是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物;溶液具有均一性和稳定性。因此,A中溶液不一定是无色的,例如硫酸铜溶液是蓝色的;B中溶质可以有多种;C中与溶液的均一性相违背;D中与溶液的均一性相符合。故选:D。命题角度:考查学生对溶质质量分数相关的计算的掌握情况。例2实验室中某瓶浓盐酸的标签如图所示.请根据有关信息计算:►类型二溶质质量分数的计算(1)该瓶盐酸溶液的质量是______g;(2)欲配制148g溶质质量分数为5%的稀盐酸,需这种浓盐酸______g;(3)40g氢氧化钠溶液跟73g溶质质量分数为5%的稀盐酸恰好完全反应。计算氢氧化钠溶液中溶质的质量分数为________。5952010%【解析】(1)从标签中可以知道盐酸的体积为500mL,密度为1.19g/cm3,可以据此求出盐酸的质量为:1.19g/cm3×500mL=595g;(2)设需要这种浓盐酸的质量为x,根据稀释前后溶质的质量不变可知:148g×5%=x•37%解得:x=20g;(3)根据题意可以知道氢氧化钠和盐酸恰好完全反应,所以盐酸中溶质的质量为:73g×5%=3.65g;设氢氧化钠溶液中溶质的质量为xNaOH+HCl═NaCl+H2O4036.5x3.65g40/x=36.5/3.65g解得:x=4g氢氧化钠溶液中溶质的质量分数为:4g/40g×100%=10%;答:氢氧化钠溶液中溶质的质量分数为10%。命题角度:考查学生对溶解度及溶解度曲线的了解。例3某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,再恢复到原温,下列各相关量的变化图像正确的是()►类型三溶解度及溶解度曲线C【解析】本题考查用图像表示变化的能力,解答本题需明确两点:(1)氢氧化钙溶解度与温度的关系;(2)生石灰放入溶液后的变化情况。生石灰能与水反应生成氢氧化钙,溶剂质量会减少,A错误;反应过程中放热使溶液的温度升高,致使氢氧化钙的溶解度降低,B错误;因为饱和溶液中溶剂的量减少,溶质的质量随之减少,温度升高溶解度降低,使得溶质的质量也随之减少,温度恢复后,溶解度增大,溶质的质量又会增大,但小于开始时的质量,C正确;温度不变,溶解度不变,饱和溶液的溶质质量分数相等,D错误。故选:C。【变式题】如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是()A.Z的溶解度随温度的升高而降低B.t1℃时,Y的溶解度大于Z的溶解度C.t3℃时,X的饱和溶液中溶质的质量分数为40%D.t2℃时,X的溶解度和Y的溶解度相等C【解析】本题通过分析溶解度曲线,考查溶解度的相关知识。关键是能从曲线图中得到正确的信息。观察图示知,X、Y的溶解度随温度的升高而增大,Z的溶解度随温度的升高而变小;t2℃时,X和Y的溶解度曲线相交,表明X的溶解度和Y的溶解度相等;t1℃时,X、Y、Z三种物质中,溶解度最大的是Y,其次是Z,最小的是X,Y的溶解度大于Z的溶解度,故A、B、D项说法皆正确;t3℃时,X的溶解度为100g,其饱和溶液中溶质的质量分数为100g/(100g+100g)×100%=50%,故C错。故选:C。谢谢
提供-鲁教版(五四制)化学九年级全一册-第一单元-溶液-复习(课件)会员下载,编号:1701027280,格式为 xlsx,文件大小为26页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载