《化学平衡》人教版高二化学选修4PPT课件(第2课时).pptx


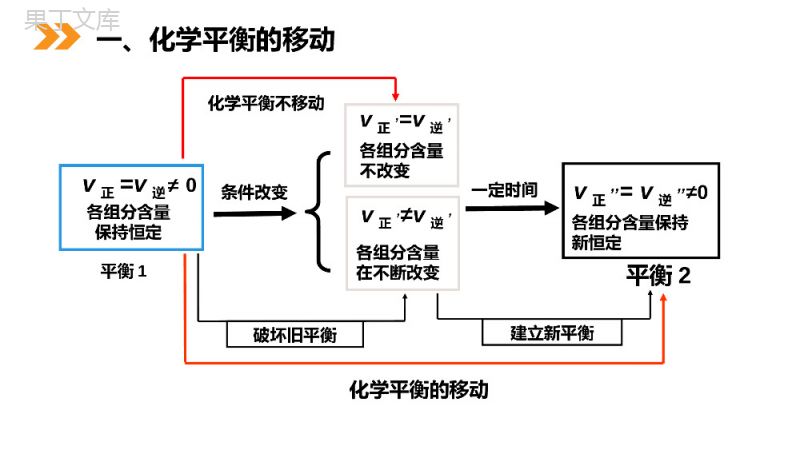


第2课时化学平衡的移动MENTALHEALTHCOUNSELINGPPT第3节化学平衡第二章化学反应速率和化学平衡人教版高中化学选修4(高二)学习目标(1)理解掌握化学平衡移动的概念;(2)了解化学平衡移动的影响因素;(3)能够画出简单的化学平衡移动的图形条件改变建立新平衡破坏旧平衡一定时间化学平衡的移动平衡1v正=v逆≠0各组分含量保持恒定v正,≠v逆,各组分含量在不断改变v正,,=v逆,,≠0各组分含量保持新恒定平衡2v正,=v逆,各组分含量不改变化学平衡不移动一、化学平衡的移动浓度压强温度催化剂改变外界条件→改变化学反应速率→改变化学平衡化学反应速率回顾:影响化学反应速率的外界条件主要有哪些?取两支试管各加入5mL0.1mol/LK2Cr2O7溶液,然后按下表步骤操作,观察并记录溶液颜色的变化。实验2-5滴加5~15滴浓硫酸滴加5~15滴6mol/LNaOH溶液K2Cr2O7溶液溶液橙色加深溶液黄色加深1、浓度对化学平衡的影响研究方法:实验设计--讨论--确立方案--动手实验—记录现象--分析原因--得出结论建立模型:1、建立平衡体系(现象明显)2、控制单一变量进行对比实验Cr2O72-(橙色)+H2OCrO42-(黄色)+2H+回顾:影响化学反应速率的外界条件主要有哪些?滴加浓硫酸滴加NaOH增大c(H+)橙色加深C(Cr2O72-)增大平衡逆向移动减小c(H+)黄色加深平衡正向移动结论:增大生成物的浓度,平衡向逆反应方向移动结论:减小生成物的浓度,平衡向正反应方向移动C(CrO42-)增大现象分析:Cr2O72-+H2O2CrO42-+2H+橙色黄色回顾:影响化学反应速率的外界条件主要有哪些?(无色)(无色)实验2-6FeCl3+3KSCNFe(SCN)3+3KCl(血红色)(黄色)编号①②步骤1滴加饱和FeCl3滴加1mol/LKSCN现象结论1步骤2滴加NaOH溶液滴加NaOH溶液现象结论2红色变深红色变深增大反应物的浓度,平衡向正反应方向移动产生红褐色沉淀,溶液红色变浅减小反应物的浓度,平衡向逆反应方向移动回顾:影响化学反应速率的外界条件主要有哪些?0vtV(正)V(逆)V(正)=V(逆)V’(正)V’(逆)V’(正)=V’(逆)增大反应物的浓度平衡正向移动0vtV(正)V(逆)V(正)=V(逆)V’(逆)V’(正)V’(正)=V’(逆)增大生成物的浓度平衡逆向移动回顾:影响化学反应速率的外界条件主要有哪些?0vtV(正)V(逆)V(正)=V(逆)V’(正)V’(逆)V’(正)=V’(逆)减小生成物的浓度平衡正向移动0vtV(正)V(逆)V(正)=V(逆)V’(逆)V’(正)V’(正)=V’(逆)减小反应物的浓度平衡逆向移动回顾:影响化学反应速率的外界条件主要有哪些?结论:其它条件不变的情况下1、增大反应物浓度或减小生成物浓度平衡向正方向移动2、增大生成物浓度或减小反应物浓度,平衡向逆方向移动结论CO2(g)+C(s)2CO(g)H0△﹥达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:不移动不变(2)增加碳,平衡,C(co).(1)增加CO2,平衡________,C(co)________。正向移动增大(3)增加CO,平衡________,C(co2)________,C(co)。逆向移动增大增大练习交流与讨论:压强的变化对化学平衡有何影响?实验探究现象:A.加压混和气体颜色先深后浅;B.减压混和气体颜色先浅后深。2NO2(气)N2O4(气)2、压强变化对化学平衡的影响在其它条件不变的情况下,增大压强,化学平衡向着气体系数和缩小的方向移动,减小压强,化学平衡向着气体系数和增大的方向移动。反应体系中有气体参加且反应前后总体积发生改变aA(g)+bB(g)cC(g)+dD(g)(a+b≠c+d)如果a+b=c+d,在其它条件不变的情况下,改变压强,v正和v逆等倍增加,对化学平衡移动无影响。压强对化学平衡的影响结论:提醒:若没有特殊说明,压强的改变就默认为改变容器容积的方法来实现,如增大压强,就默认为压缩气体体积使压强增大。2、压强变化对化学平衡的影响压强/MPa15103060100NH3/%2.09.216.435.553.669.4450℃时N2与H2反应生成NH3的实验数据N2(g)+3H2(g)2NH3(g)6000C,反应2SO3(g)2SO2(g)+O2(g)的实验数据压强/MPa0.10.51.010SO3的分解率/﹪26.314.210.54.6NH3%随着压强的增大而增大,即平衡向正反应的方向移动SO3的分解率随压强的增大而减小,即平衡向逆反应方向移动实践验证:t0vV(正)V(逆)原平衡V’(正)V’(逆)新平衡m+n>p+q0vtV(正)V(逆)原平衡V’(正)V’(逆)新平衡m+n
提供《化学平衡》人教版高二化学选修4PPT课件(第2课时).pptx会员下载,编号:1701021389,格式为 xlsx,文件大小为29页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载