《原子的结构》人教版初中化学九年级初三上册PPT课件(第3.2.2课时).pptx



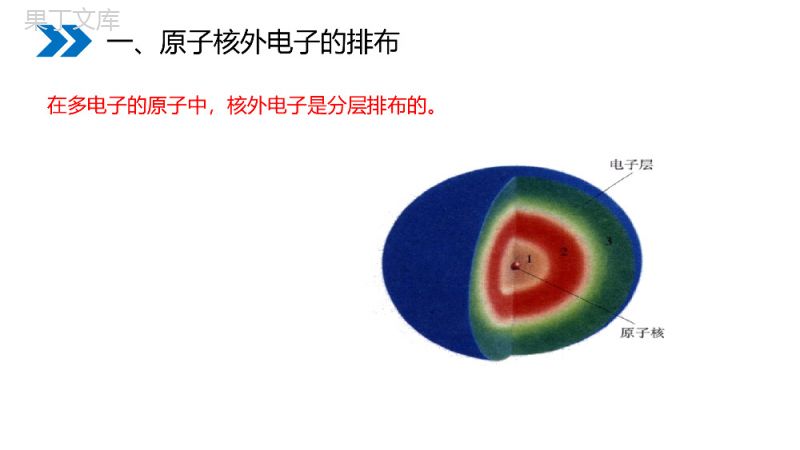

人教版初中化学九年级上册讲解人:办公资源时间:2020.6.1MENTALHEALTHCOUNSELINGPPT3.2原子的结构(第2课时)第3章物质构成的奥秘•1.质子带正电,电子带负电,中子不带电。•2.质子和中子质量近似相等,电子质量较质子和中子小得多。•3.原子的质量主要集中在原子核上。•4.原子中有:质子数=电子数,故原子不显电性。而中子数不一定等于质子数。•5.不同原子,核内质子数、核外电子数不同。•6.氢原子核内不含中子。课前回顾电子不像行星绕太阳旋转有固定的轨道,但有经常出现的区域,科学家把这样的区域称为电子层。一、原子核外电子的排布一、原子核外电子的排布在多电子的原子中,核外电子是分层排布的。1、核外电子的分层运动又称为核外电子的分层排布电子层数:一二三四五六七……符号KLMNOPQ电子能量:逐渐升高离核距离:逐渐增大一、原子核外电子的排布2、核外电子的排布规律:⑴先排内层,后排外层。⑵第一层上最多排2个电子。⑶第二层上最多排8个电子。⑷最外层上最多排8个电子。原子的结构可用原子结构示意图简明地表示。一、原子核外电子的排布2、原子结构示意图:(以氧原子为例)核外电子是分层排布的氧原子结构示意图核电荷数原子核电子层?该电子层上的电子数???画出某原子结构示意图的思路:1、原子序数→核电荷数→画出原子核2、核电荷数=核外电子数核外电子排布规律画出核外电子排布最外层电子数一、原子核外电子的排布写出下列元素的符号,画出其原子结构示意图。硫镁铍氯氟氩一、原子核外电子的排布硫S铍Be氟F氩Ar+16286+12282镁Mg+422+927氯Cl+17287+18288用原子结构示意图表示:1、比镁原子少1个质子的原子;2、原子核只有1个质子的原子;3、核电荷数为18的原子;一、原子核外电子的排布题号判断确定原子结构示意图1、比镁原子少1个质子的原子钠原子2812、原子核只有1个质子的原子氢原子3、核电荷数为18的原子是氩原子氩原子+11+11+18288一、原子核外电子的排布元素与最外层电子数的关系一、原子核外电子的排布规律;1、在同一周期中,原子的电子层数相同,最外层电子数不同,最外层电子数从左向右依次增加。2、在同一族中,最外层电子数相同,电子层数不同,从上向下电子层数依次增加。一、原子核外电子的排布根据所画出的原子结构示意图,你发现原子结构与元素原子的分类和化学性质有什么样的关系?一、原子核外电子的排布元素与最外层电子数的关系元素种类最外层电子数元素的化学性质稀有气体8个(He为2个)比较稳定一、原子核外电子的排布元素与最外层电子数的关系元素的种类最外层电子数元素的化学性质金属一般少于4个易失电子一、原子核外电子的排布元素与最外层电子数的关系元素种类最外层电子数元素的化学性质非金属一般大于或等于4个易得电子一、原子核外电子的排布3、元素分类、原子结构与元素化学性质的关系元素分类最外层电数结构的稳性化学性质不稳定结构不稳定结构稳定结构易失去最外层电子易得到电子一般不参加化学反应金属元素非金属元素稀有气体一般少于4个一般多于或等于4个(He为2个)8个电子元素元素的种类由原子的决定。元素的化学性质主要决定于原子的。核电荷数(或质子数)最外层电子数小结质子数决定元素的种类最外层电子数决定元素的化学性质(1)稀有气体元素:最外层电子数为8个(He为2个),化学性质稳定,这种结构称为稳定结构;(2)金属元素:最外层电子数少于4个,易失去电子,化学性质活泼;(3)非金属元素:最外层电子数大于或等于4个,易得到电子,化学性质活泼。结论:结构决定性质。小结在化学反应中,金属元素的原子易失去最外层电子,非金属元素的原子易得到电子,目的是达到最外层8电子的稳定结构。离子的形成化学反应中的离子:钠+氯气氯化钠点燃NaClNaCl2氯化钠的形成过程离子的形成NaCl+11281Na+17287Cl+17288Cl-+1128Na+Na+Cl-离子的形成(1)定义:带电的原子(或原子团)叫做离子.离子符号的表示方法是:在元素符号或原子团的右上角用数值和符号+、-表示电荷数和电性,“1”省略。Na﹢、Mg2+、Fe2+、Fe3+,Cl﹣、OH-、CO32-、SO42-离子的形成(2)离子的分类:阳离子:带正电的离子叫阳离子。如Na﹢、Mg2+、Fe2+阴离子:带负电的离子叫阴离子。如Cl﹣、OH-、CO32-、SO42-阴、阳离子由于静电作用而形成不带电的化合物。如:Na+与Cl-由于静电作用而结合成化合物氯化钠NaCl(请看以下图示)离子的形成+11281Na+17287Cl+17288Cl-+1128Na+Na+Cl-阳离子阴离子氯化纳(NaCl)的形成过程离子化合物易失去一个电子离子的形成阴、阳离子由于静电作用而形成不带电的化合物叫离子化合物如:Na﹢与Cl﹣由于静电作用而结合成化合物氯化钠NaCl一般来说,含金属元素的化合物是离子化合物(都是由离子构成的)NaClMgCl2KMnO4Na2CO3NaOH结论:离子也是构成物质的粒子。离子的形成由离子构成的物质NaCl由Na+和Cl-构成CuSO4由Cu2+和SO42-构成MgCl2由Mg2+和Cl-构成KMnO4由K+和MnO4-构成Na2CO3由Na+和CO32-构成NaOH由Na+和OH-构成离子的形成离子的表示方法:离子结构示意图82+11Na+离子符号8+1782Cl-在元素符号的右上角标出所带的电荷数,数值前符号在后,1可以省略不写。如:Na+Mg2+Cl-O2-离子的形成离子的结构特点:最外层均为稳定结构,且质子数与电子数不相等。离子的形成原子、离子的比较微粒种类原子离子阳离子阴离子微粒结构质=电质>电质<电电性不显正负符号用元素符号表示用阳离子符号表示用阴离子符号表示联系阳离子原子阴离子Cl和Cl﹣、Na和Na﹢离子的形成思考:阳离子中,质子数大还是电子数大?阴离子呢?它们所带的电荷数与得失电子数有什么关系?阳离子:质子数>电子数。它是原子失去电子的结果。Na﹢阴离子:质子数<电子数。它是原子得到电子的结果。Cl﹣数值相等离子的形成离子符号的意义(数字2的意义)2Mg2+表示1个镁离子带两个单位的正电荷表示两个镁离子离子的形成熟记下列离子氢氧根离子OH-硝酸根离子NO3-碳酸根离子CO32-硫酸根离子SO42-铵根离子NH4+亚铁离子Fe2+铁离子Fe3+离子的形成二、核外电子的排布排布特点1:电子在核外是分层排布的。排布特点2:原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个电子)。三、离子的形成原子结构示意图1.离子的概念:2.阴离子、阳离子:3.离子符号的书写:课堂小结例1、钠原子和钠离子的结构示意图如下(填“相同”和“不同”)⑴最外层电子数________⑵核外电子层数__________⑶核内质子数__________⑷核外电子总数________⑸粒子的电性__________⑹粒子的化学性质______⑺核内中子数__________不相同不相同相同不相同不相同不相同相同典型例题1.在化学反应里,元素的原子结构发生变化的是()A、质子数B、最外层电子数C、中子数D、核电荷数B典型例题2.某微粒的结构示意图下列有关说法中不正确的是()A、该元素原子的核外有2个电子层B、该元素是一种金属元素C、该微粒是阳离子D、该微粒最外层具有稳定结构+1382A典型例题•3、对结构示意图为•两种微粒,有下列说法•①属于同一元素②都具有稳定结构•③核外电子排布相同④都不带电荷•其中说法正确的是()•A①②B②③C①②④D②③④+1082+982B典型例题4、写出下列微粒的质子数和电子数项目NaNa+S2-NeH2ONH4+OH-质子数电子数111111101618101010101110910典型例题感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明人教版初中化学九年级上册讲解人:办公资源时间:2020.6.1MENTALHEALTHCOUNSELINGPPT感谢你的聆听第3章物质构成的奥秘
提供《原子的结构》人教版初中化学九年级初三上册PPT课件(第3.2.2课时).pptx会员下载,编号:1701020864,格式为 xlsx,文件大小为40页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载