超氧化物歧化酶(SOD)过氧化物酶(CAT)苯丙氨酸解氨酶(PAL)实验测定方法总结
本作品内容为超氧化物歧化酶(SOD)过氧化物酶(CAT)苯丙氨酸解氨酶(PAL)实验测定方法总结,格式为 doc ,大小 87040 KB ,页数为 4页
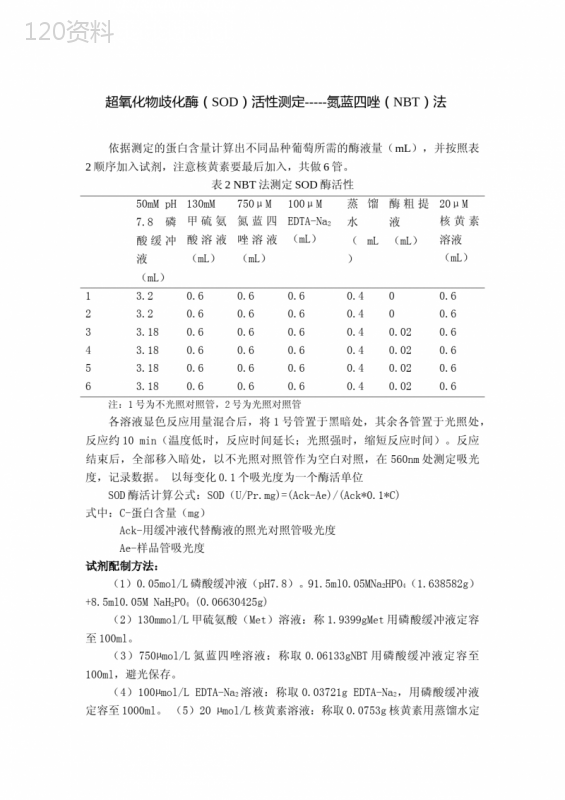
('超氧化物歧化酶(SOD)活性测定-----氮蓝四唑(NBT)法依据测定的蛋白含量计算出不同品种葡萄所需的酶液量(mL),并按照表2顺序加入试剂,注意核黄素要最后加入,共做6管。表2NBT法测定SOD酶活性50mMpH7.8磷酸缓冲液(mL)130mM甲硫氨酸溶液(mL)750μM氮蓝四唑溶液(mL)100μMEDTA-Na2(mL)蒸馏水(mL)酶粗提液(mL)20μM核黄素溶液(mL)13.20.60.60.60.400.623.20.60.60.60.400.633.180.60.60.60.40.020.643.180.60.60.60.40.020.653.180.60.60.60.40.020.663.180.60.60.60.40.020.6注:1号为不光照对照管,2号为光照对照管各溶液显色反应用量混合后,将1号管置于黑暗处,其余各管置于光照处,反应约10min(温度低时,反应时间延长;光照强时,缩短反应时间)。反应结束后,全部移入暗处,以不光照对照管作为空白对照,在560nm处测定吸光度,记录数据。以每变化0.1个吸光度为一个酶活单位SOD酶活计算公式:SOD(U/Pr.mg)=(Ack-Ae)/(Ack0.1C)式中:C-蛋白含量(mg)Ack-用缓冲液代替酶液的照光对照管吸光度Ae-样品管吸光度试剂配制方法:(1)0.05mol/L磷酸缓冲液(pH7.8)。91.5ml0.05MNa2HPO4(1.638582g)+8.5ml0.05MNaH2PO4(0.06630425g)(2)130mmol/L甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml。(3)750µmol/L氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存。(4)100µmol/LEDTA-Na2溶液:称取0.03721gEDTA-Na2,用磷酸缓冲液定容至1000ml。(5)20µmol/L核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml,避光保存。过氧化物酶(CAT)活性测定----紫外吸收法取6只试管,其中两个为对照管,依据测定的蛋白含量计算出不同品种葡萄所需的酶液量(mL),并按照表3加入试剂。表3紫外分光发测定CAT酶活性0.2MpH7.8磷酸缓冲液(mL)蒸馏水(mL)酶粗提液(mL)1(对照)1.71021.510.231.510.241.510.251.510.225℃预热后,逐管加入0.6mL0.1M的H2O2。每加完一管立即计时,并迅速倒入石英比色皿中,在260nm下测定吸光度,每隔2min读数一次,共测12min,待4个管全部测完。记录数据,计算活性。以1min内A240减少0.01的酶量为1个酶活单位(u)CAT活性计算公式(U/g.Pr/min)=△A240/(C0.01t)式中:△A240=A240(ti)—A240(tt)C—蛋白含量0.01—A240每下降0.01为1个酶活单位(u);t—加过氧化氢到最后一次读数间的时间(min)。试剂配制方法:(1)0.2MpH7.8磷酸缓冲液:0.2mol/LNa2HPO491.5ml(6.553962g)+0.2mol/LNaH2PO48.5ml(0.265217g)(2)0.1MH2O2:(30%的H2O2溶液5.68mL稀释至1000Ml)SOD同工酶研究取200uL酶粗提液,按照1:1(v/v)的比例和样品溶解液混合,室温放置15-30min。装置好垂直电泳制胶器,然后按照表4做分离胶。先倒入分离胶,大约倒到距离梳子有1cm停止,加入蒸馏水对分离胶进行水封,使胶面平整。待凝固。表4分离胶12%蒸馏水(mL)分离胶缓冲液(mL)30%Acr-Bis(mL)TEMED(uL)10%APS(uL)取量3.452.54.02070等分离胶完全凝固后,吸出蒸馏水,把按照表5配制好的浓缩胶倒入两板之间,直至凹板约0.5cm处停止,插入梳子,待凝固。表5浓缩胶4%蒸馏水(mL)浓缩胶缓冲液(mL)30%Acr-Bis(mL)TEMED(uL)10%APS(uL)取量6.22.51.332070等浓缩胶完全凝固后,缓慢拔出梳子,把电泳装置放入电泳槽,加入5×电极缓冲液,使液面高出凹板少许。按照测定的蛋白含量确定各个葡萄样本的点样量。点完样,通电电泳。在浓缩胶中以20mA的电流进行电泳,等进入分离胶后,调节电流至45mA,直至颜色样量距离胶板边缘1cm处停止。取下胶板,放入培养皿中,倒入一定量的显色液,在4℃、黑暗条件下放置30min,并不断摇匀,之后在4℃、光照条件下,摇动,直至蛋白条带显出。试剂配制方法:(1)30%Acr-Bis:29.2gAcr+0.8gBis加蒸馏水至100mL棕色瓶4℃保存(2)分离胶缓冲液:18.15gTris加50mL蒸馏水HCl调pH至8.8加蒸馏水至100mL4℃保存(3)浓缩胶缓冲液:6gTris加50mL蒸馏水HCl调pH至6.8加蒸馏水至100mL4℃保存(4)10%APS:过硫酸铵(APS)1g溶于10mL蒸馏水中(5)样品溶解液:浓缩胶缓冲液(1.0mL)甘油(0.8mL)α-巯基乙醇(0.4mL)0.1%(w/v)溴酚兰(0.4mL)蒸馏水(5.4mL)4℃保存(6)电极缓冲液pH8.3:Tris15g+Glycine(甘氨酸)72g加水至1L4℃保存(7)2.45mmol/LNBT母液:0.02003gNBT溶于10ml蒸馏水中避光保存(8)0.3mmol/L核黄素母液:0.0056454g核黄素溶于50mL蒸馏水中避光保存(9)显色液:2.45mmol/LNBT母液(5mL)0.3mmol/L核黄素母液(5mL)TEMED(167uL)EDTA-Na2(0.037224g)加蒸馏水至50mL避光保存苯丙氨酸解氨酶(PAL)活性测定取2g葡萄叶片,按4:1(mL:g)的比例加入酶提缓冲液,充分研磨后,用四层纱布过滤,然后4℃,8000rpm下离心20min,取上清液即为酶粗提液。取酶粗提液0.5mL,加入0.5mL0.02ML-苯丙氨酸1ml0.1M硼酸缓冲液(pH8.8)和0.5mL蒸馏水(空白对照不加L-苯丙氨酸而是加蒸馏水)。混匀后30℃,水浴1h,加入0.1mL6MHCl终止反应,290nm测OD值。如表6所示表6紫外分光法测定PAL酶活性酶粗提液(mL)0.02ML-苯丙氨酸(mL)0.1MpH8.8硼酸缓冲液(mL)蒸馏水(mL)6MHCl(mL)1(对照)00.5110.12(对照)0.5(灭活)0.510.50.130.50.510.50.140.50.510.50.150.50.510.50.160.50.510.50.1以每小时OD值变化0.01为1个u单位。PAL活性计算公式(U/(mg.h))=(Ack-AE)/(C0.011)式中:Ack-加入灭活酶液的对照组的吸光度Ae—样品管的吸光度C—蛋白含量(mg/mL)0.01--以每小时OD值变化0.01为1个u单位1—反应时间一个小时',)
提供超氧化物歧化酶(SOD)过氧化物酶(CAT)苯丙氨酸解氨酶(PAL)实验测定方法总结会员下载,编号:1700748250,格式为 docx,文件大小为4页,请使用软件:wps,office word 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载