临床实验注册的详细解析,中国临床实验注册

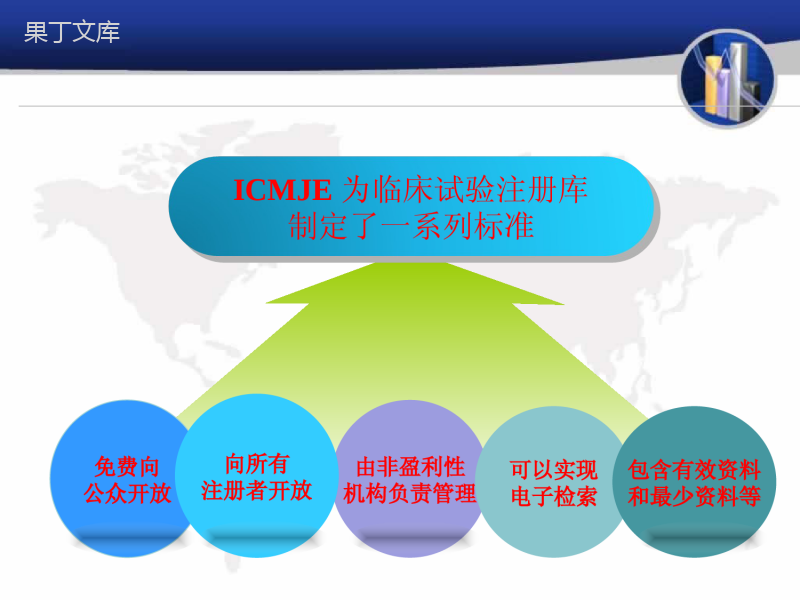



临床试验注册临床试验注册王令主要内容•什么是临床试验注册?•为什么要临床试验注册?•如何注册?•临床试验注册的展望临床试验注册简介•一种新药或干预措施的临床试验的起始阶段,需要在公共数据库上公开其所有设计信息,并跟踪已注册试验的结果。使临床试验的设计和实施透明化,让所有人都可以通过网络免费查询和评价注册的临床试验。临床试验注册简介2004年11月,由世界卫生组织(WHO)牵头建立国际临床试验注册平台(ICTRP),之后英国、美国、澳大利亚都纷纷成立了自己的临床实验注册中心。2005年在四川大学华西医院建成了中国临床试验注册中心(ChiCTR)。哪些试验应该注册?•任何以人为对象的前瞻性研究试验,都应该先注册后实施。临床试验注册的原因未注册临床试验不能成为其循证其医学贡献。国际医学期刊编辑委员会:只有注册过的临床试验的研究论文稿件才会被考虑刊登于该委员会所属的医学期刊上。当前全世界至少有近600种医学期刊遵循这个制度。学术要求伦理学要求•从伦理学角度看,病人参与临床试验,有权获悉试验结•果,保障受试者权益。主办者有责任按照伦理学的原则•进行研究并诚实地报告临床试验的结果。通过深入了解现有试验及其结果,将有助于减少不必要的重复研究。另一个重要功能是核查一稿多投,避免重复发表。提高科研效率,防止一稿多投主要的国际临床试验注册库美国国立注册资料库(http://www.clinicaltrials.gov)英国国立研究注册库(http://www.nrr.nhs.uk)澳大利亚临床试验注册库(http://www.actr.org.au/)英国当前对照试验注册库(http://www.controlled-trials.com)TrialsCentral注册库//www.trialscentral.org/)ICMJE为临床试验注册库制定了一系列标准免费向公众开放由非盈利性机构负责管理向所有注册者开放可以实现电子检索包含有效资料和最少资料等如何注册•目前中国的临床试验注册可以在中国临床注册中心以及美国的Clinical-Trials.gov上进行注册,获取全球唯一的试验注册号,便于将来在国际医学期刊上发表高质量的临床试验研究结果。ClinicalTrials.gov•ClinicalTrials.gov是美国政府创建的第一个临床试验资料库,而且同时提供试验注册服务,2004年后开始对国际上的临床试验开放•ClinicalTrials.gov被列为公开化、国际化临床试验注册的典范。•http://prsinfo.clinicaltrials.gov/gettingOrgAccount.html•注册个人PRS账号两个工作日之ClinicalTrials.gov就可生成账号并通过电子邮件说明如何在PRS上注册临床试验。中国临床试验注册中心(ChiCTR)•ChiCTR作为世界卫生组织国际临床试验注册平台一级注册机构,依托卫生部中国循证医学中心、和国际临床流行病学网、华西资源与培训中心,联合多家核心期刊(现增至52家)于2006年4月发起成立了中国临床试验注册与发表协作网。中国临床试验注册中心(ChiCTR)•2004年开始筹建,2005年开始受理注册申请。•2007年7月25日,临床试验注册中心在四川大学华西医院开始运行。注册方式注册方式中国临床注册中心收费中、英文双语注册注册是否需要费用?免费500元1500元?3000元研究设计指导费伦理审查、费用研究方案、CRF表工作流程和知情同意书研究计划书制订每项3000元注册流程注册流程注册流程注册流程注册流程临床试验注册的未来futuerfutuer强制性透明化必要性谢谢谢谢
提供临床实验注册的详细解析,中国临床实验注册会员下载,编号:1701026929,格式为 xlsx,文件大小为27页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载