《原电池》人教版高二化学选修4PPT课件.pptx


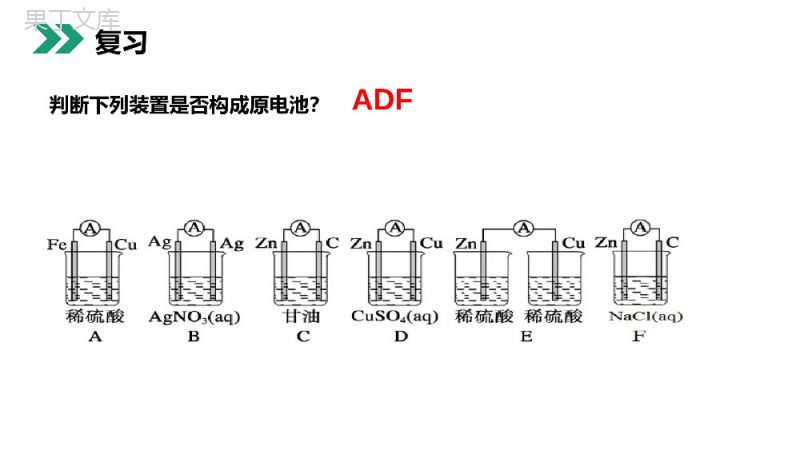

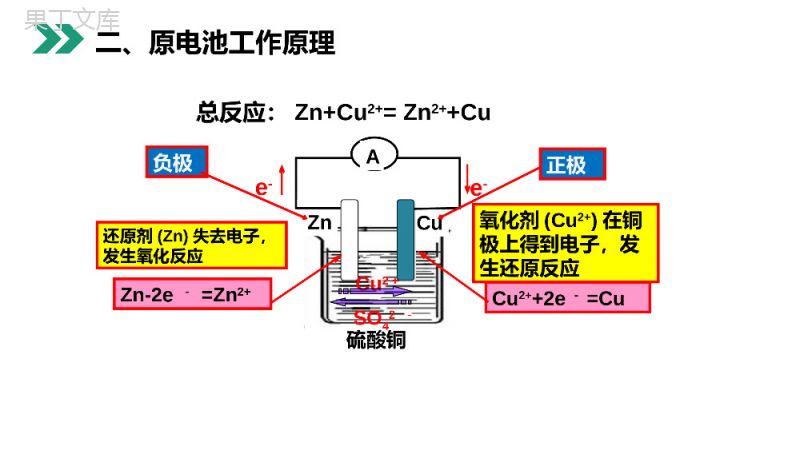
老师:68素材MENTALHEALTHCOUNSELINGPPT第一节原电池第四章电化学基础人教版高中化学选修4(高二)学习目标1.以铜锌电池为例,熟悉原电池的工作原理。2.会正确判断原电池的正极和负极。3.掌握原电池电极反应式的书写和方法。判断下列装置是否构成原电池?ADF复习活泼性不同电解质闭合一、构成原电池的条件:硫酸铜CuZnAe-e-Zn-2e-=Zn2+还原剂(Zn)失去电子,发生氧化反应氧化剂(Cu2+)在铜极上得到电子,发生还原反应Cu2++2e-=CuCu2+SO42-负极正极总反应:Zn+Cu2+=Zn2++Cu二、原电池工作原理1、原电池是___________________的装置。原电池反应的本质是_____________反应。2、如右图所示,组成的原电池:(1)当电解质溶液为稀H2SO4时:Zn电极是____(填“正”或“负”)极,其电极反应为____________,该反应是____(填“氧化”或“还原”,下同)反应;Cu电极是___极,其电极反应为___________,该反应是____反应。(2)当电解质溶液为CuSO4溶液时:Zn电极是____极,其电极反应为_____________,该反应是______反应;Cu电极是____极,其电极反应为____________,该反应_____反应.负Zn-2e-=Zn2+氧化正2H++2e-=H2↑还原负Zn-2e-=Zn2+氧化正Cu2++2e-=Cu还原将化学能转化为电能氧化还原反应二、原电池工作原理装置电极名称__________负极正极3.有盐桥的原电池的工作原理(以锌铜原电池为例):二、原电池工作原理电极材料Zn电极Cu电极实验现象Zn棒逐渐_____Cu棒逐渐_____电流表指针发生偏转得失电子______________电子流向__________电流方向__________溶液离子______________________________电极反应式____________________________总反应_________________变细变粗失电子得电子流出流入流入流出阴离子移向负极阳离子移向正极Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu二、原电池工作原理盐桥的作用:(1)成分:含有____________的琼脂。(2)离子移动方向:Cl-移向_____________(负极区),K+移向_____________(正极区)。(3)作用:使两个半电池形成通路,并保持两溶液的电中性。KCl饱和溶液ZnSO4溶液CuSO4溶液二、原电池工作原理利用反应原理Cu+2Ag+=Cu2++2Ag设计一个能得到稳定电流的原电池装置,画出装置简图,并标注电极及电解质溶液Ag例题判断下列电极名称内容原电池电子流入的一极溶液中阳离子移向的一极发生氧化反应铜-锌-稀硫酸原电池有气泡放出电极质量减轻正极正极负极正极负极例题控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池.下列判断不正确的是()A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极D例题1.加快化学反应速率:构成原电池的反应速率比直接接触的反应速率___。如实验室制H2时,粗锌比纯锌与稀硫酸反应快,或向溶液中滴入几滴CuSO4溶液,反应加快。快快2.比较金属的活动性强弱:对于酸性电解质,一般是作负极的金属活动性___,作正极的金属活动性较___。强弱二、原电池原理的应用3.设计原电池:(1)理论上:自发进行的_________反应,可以设计成原电池。(2)外电路。负极—_____性较强的物质被_____;正极—_____性较强的物质被_____氧化还原还原氧化氧化还原二、原电池原理的应用a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序为()A.a>b>c>dB.a>c>d>bC.c>a>b>dD.b>d>c>aB例题1.一般电极反应式的书写方法(1)定电极,标得失。按照负极发生氧化反应,正极发生还原反应,判断出电极反应产物,找出得失电子的数量。(2)看环境,配守恒。电极产物在电解质溶液的环境中,应能稳定存在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式要依据电荷守恒和质量守恒、得失电子守恒等加以配平。(3)两式加,验总式。两电极反应式相加,与总反应方程式对照验证。[归纳总结]2.已知总反应式,书写电极反应式(1)分析化合价,确定正极、负极的反应物与产物。(2)在电极反应式的左边写出得失电子数,使得失电子守恒。(3)根据质量守恒配平电极反应式。(4)[归纳总结]3.原电池的设计从理论上讲,任何一个自发的氧化还原反应都可以设计成原电池。关键是选择合适的电解质溶液和两个电极。(1)电解质溶液:一般能与反应,或者溶解在溶液中的物质(如O2)与反应。(2)电极材料:一般较活泼的金属作,较不活泼的金属或非金属导体作。负极负极负极正极[归纳总结]B1.关于原电池的叙述中正确的是()A.构成原电池的两极必须是两种不同金属B.原电池是将化学能转化为电能的装置C.原电池工作时总是负极溶解,正极上有物质析出D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原练习:2.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:卡片上的描述合理的是()A.①②③B.③④⑤C.①⑤⑥D.②③④B练习:老师:68素材MENTALHEALTHCOUNSELINGPPT感谢各位的聆听第四章电化学基础人教版高中化学选修4(高二)感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明
提供《原电池》人教版高二化学选修4PPT课件.pptx会员下载,编号:1701020906,格式为 xlsx,文件大小为22页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载