《pH的相关计算》人教版高二化学选修4PPT课件.pptx



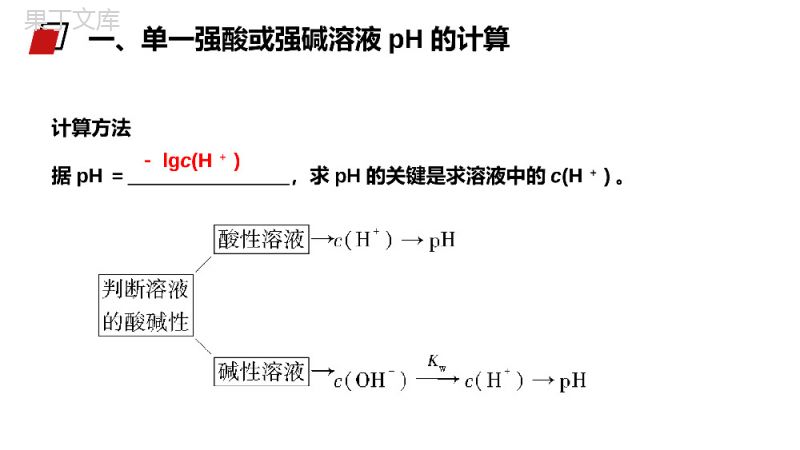

老师:68素材MENTALHEALTHCOUNSELINGPPT第二节pH的相关计算第三章水溶液中的离子平衡人教版高中化学选修4(高二)学习目标1.掌握pH的简单计算,了解各类混合溶液pH的计算。(难点)2.了解溶液稀释时pH的变化规律。(重点)1、若溶液呈酸性,先求c(H+)→再求pH=-lgc(H+)。2、若溶液呈碱性,先求c(OH-)→再求c(H+)=KW/c(OH-)→最后求pH。总的原则-lgc(H+)计算方法据pH=,求pH的关键是求溶液中的c(H+)。一、单一强酸或强碱溶液pH的计算例1:常温下,计算浓度为0.05mol/L的硫酸溶液的pH。解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/LpH=-lgc(H+)=1例题解:c(OH-)=2c[Ba(OH)2]=0.005×2=10-2mol/Lc(H+)=KWc(OH—)=10-12mol/LpH=-lgc(H+)=12例2:常温时,计算浓度为0.005mol/L的氢氧化钡溶液的pH。例题nc-lgncncKWnc-lgKWnc总结:强酸和强碱溶液的pH计算(1)强酸溶液(以cmol·L-1的HnA溶液为例)c(H+)=mol·L-1pH=-lgc(H+)=。(2)强碱溶液[以cmol·L-1的B(OH)n溶液为例]c(OH-)=mol·L-1c(H+)=,pH=-lgc(H+)=总结KWnc-lgKWnc练习1计算25℃时,下列溶液的pH。(1)0.005mol·L-1的H2SO4溶液;(2)0.005mol·L-1的Ba(OH)2溶液。解析:(1)c(H+)=2c(H2SO4)=2×0.005mol·L-1=0.01mol·L-1,pH=2;(2)c(OH-)=2c[Ba(OH)2]=2×0.005mol·L-1=0.01mol·L-1,c(H+)=KW/c(OH-)=10-12mol·L-1,pH=12。例题解:IIIIIIVVHnHn)()(c(H+)==10-5V+10-3V2V≈10-3V2V=10—32mol/LpH=—lgc(H+)=3.3例3pH=5和pH=3的两种盐酸,以等体积混合后,计算溶液的pH。例题解:c(OH-)==10-4V+10-2V2V≈10-2V2V=10-22mol/LpH=-lgc(H+)=11.7n1(OH-)+n2(OH-)V总c(H+)=KWc(OH-)=2×10—12mol/L例4:常温时,将pH=10的NaOH溶液与pH=12的NaOH溶液以1:2体积比混合,混合后的pH为多少?例题例8:将pH=3的盐酸溶液,稀释10倍,100倍,10000倍,计算稀释溶液的pH稀释10倍c(H+)=10—3V10V=10—4mol/LpH=—lgc(H+)=4稀释100倍c(H+)=10—3V100VpH=—lgc(H+)=5=10—5mol/L稀释10000倍c(H+)=10—3V10000V1、强酸或强碱稀释=10—8mol/LpH=—lgc(H+)=8×例题稀释10000倍pH=—lgC(H+)=6.99c(H+)=10—3V+9999V×10—710000Vc(H+)=(10—8+10—7)mol/L总结:强酸每稀释倍,pH增加1个单位,当把酸电离出的氢离子稀释到接近10—7mol/L时候要考虑水的电离,pH<7。=1.1×10—7mol/L例题总结:稀释后溶液pH的变化规律(1)对于强酸溶液(pH=a)每稀释10n倍,pH增大n个单位,即pH=a+n(a+n<7)。(2)对于强碱溶液(pH=b)每稀释10n倍,pH减小n个单位,即pH=b-n(b-n>7)。(3)对于弱酸溶液(pH=a)每稀释10n倍,pH的范围是:a
提供《pH的相关计算》人教版高二化学选修4PPT课件.pptx会员下载,编号:1701021156,格式为 xlsx,文件大小为26页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载