《影响盐类水解因素及利用》人教版高二化学选修4PPT课件.pptx


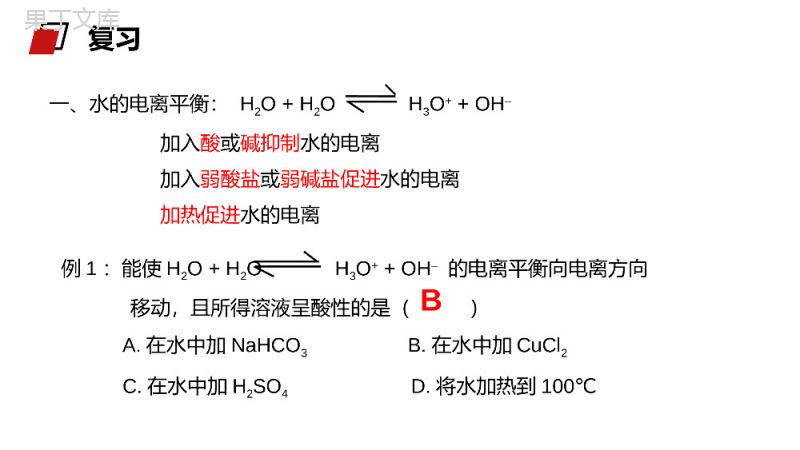


老师:办公资源MENTALHEALTHCOUNSELINGPPT第三节影响盐类水解因素及利用第三章水溶液中的离子平衡人教版高中化学选修4(高二)学习目标1.掌握水的电离平衡;2.巩固盐类水解的概念;3.掌握影响盐类水解的因素及其利用。一、水的电离平衡:H2O+H2OH3O++OH–加入酸或碱抑制水的电离加入弱酸盐或弱碱盐促进水的电离加热促进水的电离例1:能使H2O+H2OH3O++OH–的电离平衡向电离方向移动,且所得溶液呈酸性的是()A.在水中加NaHCO3B.在水中加CuCl2C.在水中加H2SO4D.将水加热到100℃B复习例2判断下列盐溶液的酸碱性,能水解的写出水解的离子方程式:(NH4)2SO4FeSO4NaFNaHSO4NaINa2SO3NaHCO3二、盐类水解水解的规律:1.有弱才水解,无弱不水解;2.越弱越水解,都弱双水解;3.谁强显谁性,同强显中性。例:现有S2-、SO32-、NH4+、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:(1)在水溶液中该离子水解呈碱性的是;(2)在水溶液中该离子水解呈酸性的是;(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液中大量存在的离子有;(4)既不能在酸性较强的溶液里大量存在,又能在碱性较强的溶液中大量存在的离子有;S2-、SO32-、HPO42-、AlO2-、HCO3-NH4+、Al3+、Fe3+Na+、SO42-、Cl-HPO42-、HCO3-二、盐类水解1、内因:盐本身的性质:组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度越大。越弱越水解探究一影响盐类水解的主要因素①不同弱酸对应的盐对应的酸:HClOH2CO3
提供《影响盐类水解因素及利用》人教版高二化学选修4PPT课件.pptx会员下载,编号:1701020847,格式为 xlsx,文件大小为23页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载