《化学电源》人教版高二化学选修4PPT课件.pptx


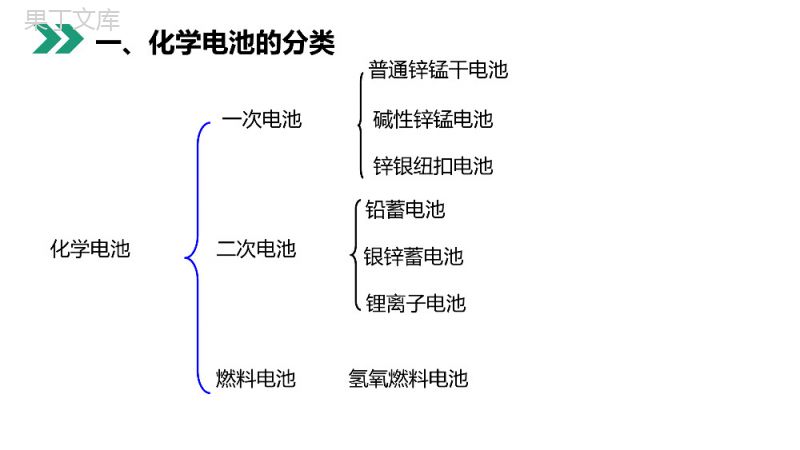
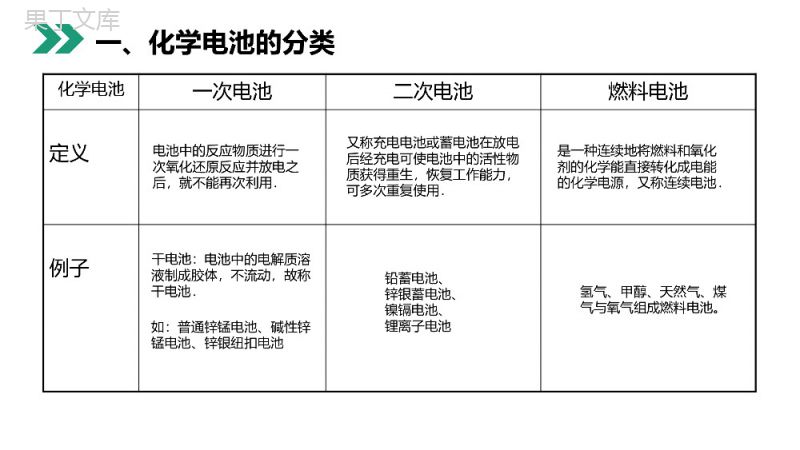

老师:68素材MENTALHEALTHCOUNSELINGPPT第二节化学电源第四章电化学基础人教版高中化学选修4(高二)学习目标1、了解电池的一般分类。2、掌握几种典型电池的用途和特点。3、掌握几种典型化学电池的电极反应式。化学电池一次电池二次电池燃料电池碱性锌锰电池铅蓄电池氢氧燃料电池锂离子电池银锌蓄电池普通锌锰干电池锌银纽扣电池一、化学电池的分类化学电池一次电池二次电池燃料电池定义例子电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用.又称充电电池或蓄电池在放电后经充电可使电池中的活性物质获得重生,恢复工作能力,可多次重复使用.是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电源,又称连续电池.干电池:电池中的电解质溶液制成胶体,不流动,故称干电池.铅蓄电池、锌银蓄电池、镍镉电池、锂离子电池氢气、甲醇、天然气、煤气与氧气组成燃料电池。如:普通锌锰电池、碱性锌锰电池、锌银纽扣电池一、化学电池的分类例1关于原电池的说法正确的是()A.在正极上发生氧化反应B.某电极上有氢气产生,则此电极为正极C.在外电路电子流出的为正极D.在负极上发生还原反应B例题例2关于下图所示的原电池,下列说法正确的是()A.锌是电池的负极,发生还原反应B.盐桥中的阳离子向硫酸铜溶液中迁移C.电流从锌电极通过电流计流向铜电极D.铜电极上发生的电极反应是2H++2e-====H2↑B例题正极:Ag2O+H2O+2e-=2Ag+2OH-负极:Zn+2OH--2e-=Zn(OH)2总反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag优点:电池比能量大、电压稳定,储存时间长,适宜小电流和连续放电。电解液:KOH银锌原电池是用不锈钢制成的小圆盒,形似纽扣,故称纽扣电池。盒内一端填充氧化银和石墨组成的活性材料,另一端填充锌汞合金组成的活性材料。1、银锌电池二、一次电池例3微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为Zn+2OH--2e-====Zn(OH)2;Ag2O+H2O+2e-====2Ag+2OH-,根据上述反应式,判断下列叙述正确的是()A.在使用过程中,电池负极区溶液的c(OH-)增大B.使用过程中,电子由Ag2O极经外电路流向Zn极C.Zn是负极,Ag2O是正极C例题3、碱性锌-锰干电池电解质:KOH负极:Zn+2OH--2e-=Zn(OH)2正极:2MnO2+2H2O+2e-=2MnOOH+2OH-缺点:多数只能一次使用,不能充电;价格较贵优点:比能量和储存时间有所提高,适用于大电流和连续放电。电池反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2二、一次电池4、锂电池(非水有机溶剂电解液)负极:2Li-2e-=2Li+,正极:I2+2e-=2I-,总反应:2Li+I2=2LiI跟其它金属作负极相比,使用寿命延长,高能、质轻、电压高、工作效率高、储存寿命长。为什么?与作负极材料的金属相比较,相同质量时锂提供电子数最多。二、一次电池1、铅蓄电池是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb三、二次电池放电过程总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2OPb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=2PbSO4+2H2O氧化反应还原反应负极:⑴放电过程(是原电池反应,化学能转化为电能)铅蓄电池充电的反应则是上述反应的逆过程人们常根据硫酸密度的大小来判断铅蓄电池是否需要充电三、二次电池⑵充电过程(是电解池反应,电能转化为化学能)PbSO4+2e-=Pb+SO42-还原反应阴极:阳极:PbSO4+2H2O-2e-=PbO2+4H++SO42-氧化反应接电源负极接电源正极充电过程总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4铅蓄电池的充放电过程:Pb+PbO2+2H2SO42PbSO4+2H2O放电充电人们常根据硫酸密度的大小来判断铅蓄电池是否需要充电三、二次电池缺点:比能量低、笨重、废弃电池污染环境优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉其它二次电池镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……三、二次电池1.镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是()A.镁条作负极,电极反应:Mg-2e-====Mg2+B.铝片作负极,电极反应:Al+4OH--3e-====+2H2OC.电流从Al电极沿导线流向Mg电极D.铝片上有气泡产生2AlOB练习2AlO2.如图所示装置,电流计的指针发生偏转,正极变粗,负极变细,符合这种情况的是()A.正极Cu,负极Zn,S为稀硫酸B.正极Zn,负极Cu,S为CuSO4溶液C.正极Ag,负极Zn,S为AgNO3溶液D.正极Fe,负极Cu,S为AgNO3溶液C练习3.铜锌原电池如图工作时,下列叙述正确的是()A.正极反应为Zn-2e-====Zn2+B.电池反应为Zn+Cu2+====Zn2++CuC.在外电路中,电流从负极流向正极D.盐桥中的K+移向ZnSO4溶液B练习一、原电池的工作原理和正、负极的判断1.原电池的工作原理:归纳总结(1)反应类型:负极发生氧化反应,正极发生还原反应。(2)电子的移动方向:电子从负极流出,经导线流向正极。(3)离子的移动方向:阳离子向正极移动,阴离子向负极移动。归纳总结2.原电池正负极的判断:归纳总结二、原电池电极反应式的书写1.书写电极反应的原则:电极反应是氧化还原反应,要遵循质量守恒、电子守恒及电荷守恒。另外还遵循:(1)加和性原则:两电极反应相加,消去电子后得电池总反应式。利用此原则,电池总反应式减去已知的一电极反应得另一电极反应。归纳总结(2)共存原则:碱性溶液中,CO2不可能生成,也不会有H+参加反应或生成;同样酸性溶液中,不会有OH-参加反应或生成。根据此原则,物质得失电子后在不同的电解质环境中所存在的形式不同。归纳总结2.根据装置书写电极反应式:首先根据题目给定的图示装置特点,结合原电池正负极的判断方法,确定原电池的正负极及放电的物质。(1)负极反应:活泼金属或H2(或其他还原剂)失去电子生成金属阳离子或H+(或其他氧化产物)。若电解质溶液中的阴离子与生成的金属阳离子或H+能反应,则该阴离子应写入电极反应式,如归纳总结①铅蓄电池的负极反应是Pb+-2e-====PbSO4。②H2参加反应的原电池(碳或Pt为电极),通入H2的一极为负极,有三种写法:若为中性或酸性电解质溶液:H2-2e-====2H+;若为碱性电解质溶液:H2+2OH--2e-====2H2O;24SO归纳总结24SO感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明老师:68素材MENTALHEALTHCOUNSELINGPPT感谢各位的聆听第四章电化学基础人教版高中化学选修4(高二)
提供《化学电源》人教版高二化学选修4PPT课件.pptx会员下载,编号:1701020848,格式为 xlsx,文件大小为26页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载