《金属晶体》高二上册化学选修三PPT课件(第1课时).pptx




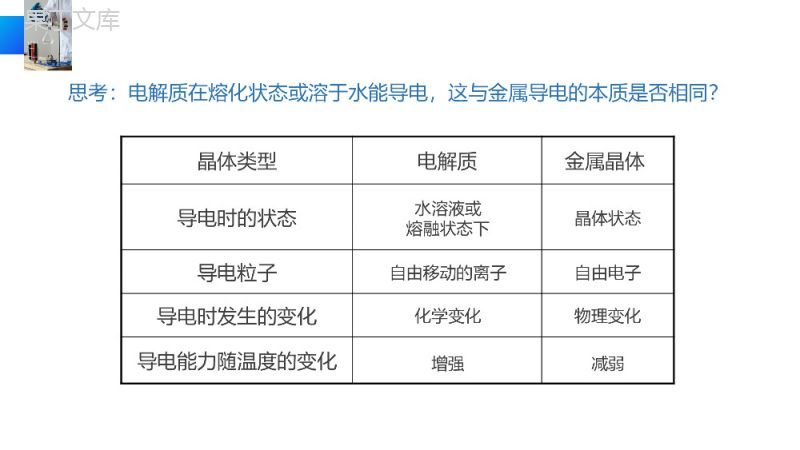
晶体结构与性质金属晶体与离子晶体20XX.XX.XXMETALCRYSTALANDIONICCRYSTAL老师:办公资源高中化学选修三01Ti金属样品思考1:从上述的金属的应用来说,金属有哪些共同的物理性质呢?一、金属共同的物理性质比较易导电、导热、有延展性、有金属的光泽等思考2:金属为什么具有这些共同性质呢?二、金属的结构1、电子气理论:由于金属原子的最外层电子数比较少,容易失去电子形成为金属离子,金属原子释放出的价电子不专门属于某个特定的金属离子,而为许多的金属离子所共有,并在整个金属中自由运动,这些电子又称之为自由电子。金属脱落下来的价电子几乎均匀分布在整个晶体中,像遍布整块金属的“电子气”,从而把所有金属原子维系在一起。组成粒子:金属阳离子和自由电子3、金属晶体:通过金属键结合形成的单质晶体。金属单质和合金都属于金属晶体微粒间作用力:金属键2、金属键:金属离子和自由电子之间的强烈的相互作用叫做金属键(电子气理论)特征:金属键可看成是由许多原子共用许多电子的一种特殊形式的键,这种键既没有方向性,也没有饱和性,金属键的特征是成键电子可以在金属中自由流动,使得金属呈现出特有的属性。4、电子气理论对金属的物理性质的解释在金属晶体中,充满着带负电的“电子气”(自由电子),这些电子气的运动是没有一定方向的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电。不同的金属导电能力不同,导电性最强的三中金属是:Ag、Cu、Al⑴金属导电性的解释晶体类型电解质金属晶体导电时的状态导电粒子导电时发生的变化导电能力随温度的变化水溶液或熔融状态下晶体状态自由移动的离子自由电子思考:电解质在熔化状态或溶于水能导电,这与金属导电的本质是否相同?化学变化物理变化增强减弱“电子气”(自由电子)在运动时经常与金属离子碰撞,引起两者能量的交换。当金属某部分受热时,那个区域里的“电子气”(自由电子)能量增加,运动速度加快,通过碰撞,把能量传给金属离子。“电子气”(自由电子)在热的作用下与金属原子频繁碰撞从而把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。⑵金属导热性的解释当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以在各原子层之间发生相对滑动以后,仍可保持这种相互作用,因而即使在外力作用下,发生形变金属键不易断裂。因此,金属都有良好的延展性。⑶金属延展性的解释自由电子+金属离子金属原子错位+++++++++++++++++++++++++++++++++++++++++++导电性导热性延展性金属离子和自由电子自由电子在外加电场的作用下发生定向移动自由电子与金属离子碰撞传递热量晶体中各原子层相对滑动仍保持相互作用【总结】金属晶体的结构与性质的关系由于自由电子可吸收所有频率的光,然后很快释放出各种频率的光,因此绝大多数金属具有银白色或钢灰色光泽。而某些金属(如铜、金、铯、铅等)由于较易吸收某些频率的光而呈现较为特殊的颜色。当金属成粉末状时,金属晶体的晶面取向杂乱、晶格排列不规则,吸收可见光后辐射不出去,所以成黑色。(4)金属光泽和颜色金属阳离子所带电荷越多、离子半径越小,金属键越强。一般情况下,金属晶体熔点由金属键强弱决定。金属键越强,熔点就相应越高,硬度也越大。影响金属键强弱的因素:金属原子价电子越多,原子半径越小,金属离子与自由电子的作用力就越强,晶体的熔沸点就越高,反之越低。(5)熔点和沸点【思考4】已知碱金属元素的熔沸点随原子序数的增大而递减,试用金属键理论加以解释。【思考5】试判断钠、镁、铝三种金属熔沸点和硬度的大小。同周期元素,从左到右,价电子数依次增大,原子(离子)半径依次减弱,则单质中所形成金属键依次增强,故钠、镁、铝三种金属熔沸点和硬度的大小顺序是:钠<镁<铝。同主族元素价电子数相同(阳离子所带电荷数相同),从上到下,原子(离子)半径依次增大,则单质中所形成金属键依次减弱,故碱金属元素的熔沸点随原子序数的增大而递减。1、金属晶体熔点变化较大,与金属晶体紧密堆积方式、金属阳离子与自由电子之间的金属键的强弱有密切关系.熔点最低的金属:汞(常温时成液态);熔点很高的金属:钨(3410℃);铁的熔点:1535℃2、一般情况下,金属晶体熔点由金属键强弱决定:金属阳离子半径越小,所带电荷越多,自由电子越多,金属键越强,熔点就相应越高,硬度也越大。但金属性越弱如:KNaMgAlLiNaKRbCs﹥﹥﹥﹥﹤﹤﹤金属晶体熔点变化规律熔点最低的金属是--------汞[-38.87℃]熔点最高的金属是--------钨[3410℃]密度最小的金属是--------锂[0.53g/cm3]密度最大的金属是--------锇[22.57g/cm3]硬度最小的金属是--------铯[0.2]硬度最大的金属是--------铬[9.0]最活泼的金属是----------铯最稳定的金属是----------金延性最好的金属是--------铂[铂丝直径:mm]展性最好的金属是--------金[金箔厚:mm]50001100001金属之最50001100001晶体类型共价晶体分子晶体金属晶体概念作用力构成微粒物理性质熔沸点硬度导电性实例共价键范德华力金属键原子分子金属阳离子和自由电子很高很低差别较大很大很小差别较大无(硅为半导体)无导体相邻原子之间以共价键相结合而成具有空间网状结构的晶体分子间以范德华力相结合而成的晶体通过金属键形成的晶体金刚石、二氧化硅、晶体硅、碳化硅Ar、S等Au、Fe、Cu、钢铁等知识回顾:三种晶体类型与性质的比较1、金属晶体的形成是因为晶体中存在()A.金属离子间的相互作用B.金属原子间的相互作用C.金属离子与自由电子间的相互作用D.金属原子与自由电子间的相互作用2、金属能导电的原因是()A.金属晶体中金属阳离子与自由电子间的相互作用较弱B.金属晶体中的自由电子在外加电场作用下可发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子CB练习金属键的特征:自由电子可以在整块金属中自由移动,因此金属键没有方向性和饱和性。金属键的本质:金属键“电子气理论”(自由电子理论)金属原子脱落来的价电子形成遍布整个晶体的“电子气”,被所有原子所共用,从而把所有的原子维系在一起。金属阳离子和自由电子。存在于金属单质和合金中。金属键的成键微粒:小结THANKS20XX.XX.XXMETALCRYSTALANDIONICCRYSTAL老师:办公资源高中化学选修三感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明
提供《金属晶体》高二上册化学选修三PPT课件(第1课时).pptx会员下载,编号:1701020904,格式为 xlsx,文件大小为16页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载