《化学平衡》人教版高二化学选修4PPT课件(第4课时).pptx


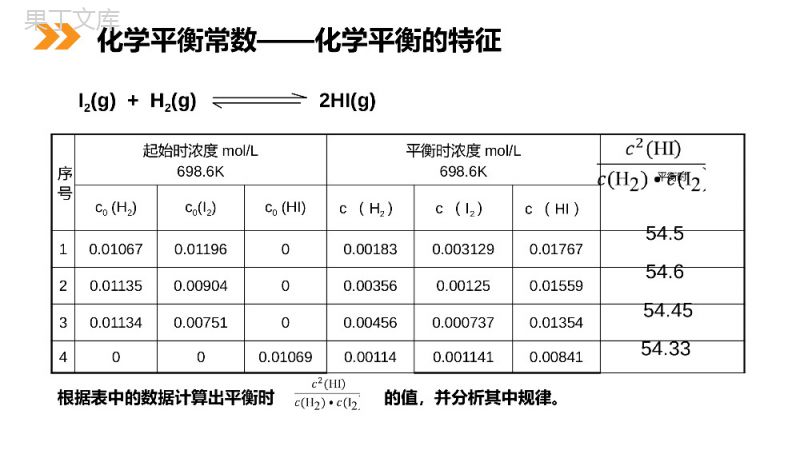


第4课时化学平衡常数及计算MENTALHEALTHCOUNSELINGPPT第三节化学平衡第二章化学反应速率和化学平衡人教版高中化学选修4(高二)措施原因加入过量的N2促进平衡,提高的转化率采用适当的催化剂反应速率采用高压有利于平衡向移动采用较高温同时提高催化剂的活性将氨液化并及时分离有利于平衡向移动正向移动H2加快正反应方向加快反应速率正反应方向应用工业合成氨反应为N2(g)+3H2(g)2NH3(g)ΔH<0课前导入序号起始时浓度mol/L698.6K平衡时浓度mol/L698.6K平衡时c0(H2)c0(I2)c0(HI)c(H2)c(I2)c(HI)10.010670.0119600.001830.0031290.0176720.011350.0090400.003560.001250.0155930.011340.0075100.004560.0007370.013544000.010690.001140.0011410.00841I2(g)+H2(g)2HI(g)54.554.654.4554.33根据表中的数据计算出平衡时的值,并分析其中规律。化学平衡常数——化学平衡的特征通过分析实验数据得出:1、温度不变时,为常数用K表示;2、常数K与反应的起始浓度大小无关;3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。)()()(222IcHcHIc思维建模:其它平衡体系的数据进行分析,都有类似的关系。)()()()(BcAcDcCcKbadc对于反应:aA+bBcC+dD化学平衡常数——化学平衡的特征)()()(222IcHcHIc)()()()(BcAcDcCcKbadc(1)定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),符号用“K”表示。1、化学平衡常数、定义、数学表达式、单位化学平衡常数的特点:化学平衡常数只与反应本身及温度有关,与压强、起始浓度、起始反应方向均无关。一、化学平衡常数∴K的单位为(mol·L-1)n;n=(p+q)-(m+n)∵浓度的单位为mol·L-1※当浓度的单位为mol·L-1,称标准平衡常数,标准平衡常数不写单位K=(2)数学表达式(3)K的单位:一、化学平衡常数(1)纯固体纯液体浓度固定,不能写在平衡关系式中。CaCO3(s)CaO(s)+CO2(g)例如:K=Fe3O4(s)+4H2(g)高温3Fe(s)+4H2O(g)c(CO2))H(c)OH(c2424K=CO2(g)+H2(g)CO(g)+H2O(l)2、书写平衡常数关系式的规则Cr2O72-+H2O2CrO42-+2H+K=)Cr2O72-(c)CrO42-(c2)H+(c2K=c(CO)/c(CO2)c(H2)一、化学平衡常数(2)同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。N2+3H22NH3)H(c)N(c)NH(cK2323212NH3N2+3H2)NH(c)H(c)N(cK3223221/2N2+3/2H2NH3)H(c)N(c)NH(cK//22322133K1=1/K2=K32化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变。一、化学平衡常数)H(c)N(c)NH(cK232321)NH(c)H(c)N(cK322322)H(c)N(c)NH(cK//22322133(3)多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)例2NO(g)+O2(g)2NO2(g)K12NO2(g)N2O4(g)K22NO(g)+O2(g)N2O4(g)K=K1K2一、化学平衡常数(1)平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。若正反应是吸热反应,升高温度,K增大;若正反应是放热反应,升高温度,K减小。3、平衡常数K的意义温度623K698K763K平衡常数66.954.445.9通过改变温度,平衡常数大小的变化趋势可以判断上可逆反应的正方向是放热反应.例如:不同温度时,反应:H2(g)+I2(g)2HI(g),的浓度平衡常数与温度的关系如下:一、化学平衡常数(2)平衡常数K值的大小,可推断反应进行的程度。K值越大,表示反应进行的程度越大,反应物的转化率越大;K值越小,表示反应进行的程度越小,反应物的转化率越小。(3)反应的平衡常数与反应可能进行的程度。一般来说,反应的平衡常数K≥105,认为正反应进行得较完全;K≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。一、化学平衡常数对于可逆反应:mA(g)+nB(g)pC(g)+qD(g)(4)在某温度下,某时刻反应是否达平衡,可用该时刻产物的浓度幂的之积与反应物浓度幂之积的比即浓度商Q与K比较大小来判断。QC>kc,未达平衡,逆向进行。逆正QC=kc,达平衡,平衡不移动。逆正逆正QC
提供《化学平衡》人教版高二化学选修4PPT课件(第4课时).pptx会员下载,编号:1701021389,格式为 xlsx,文件大小为26页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载