《共价键》高二上册化学选修三PPT课件(第2课时).pptx


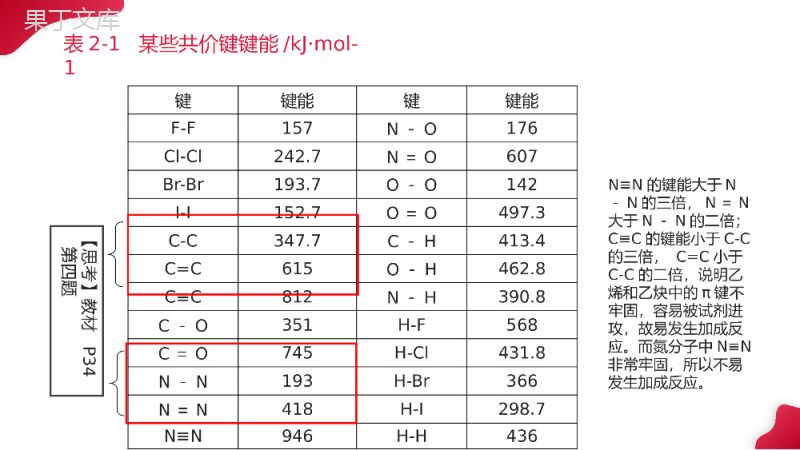
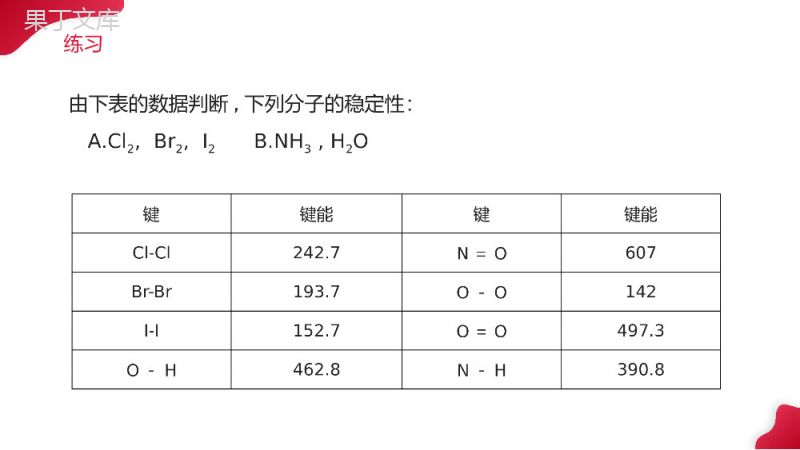
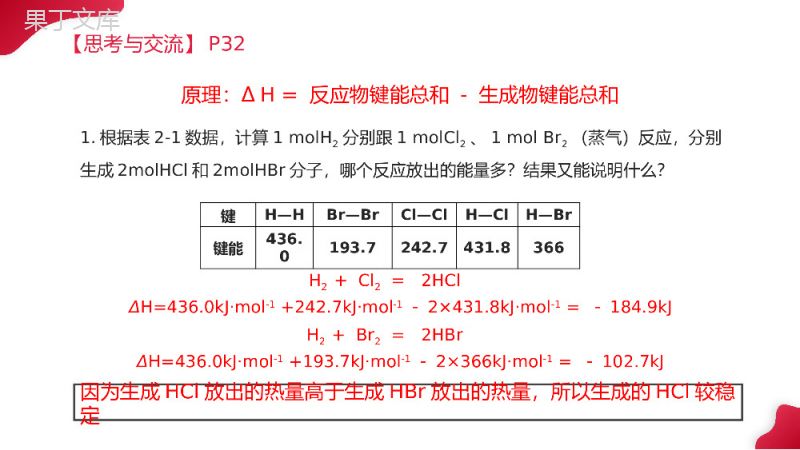
共价键分子结构与性质SOCIALASSISTANCEFORTHEWEAK汇报人:办公资源汇报时间:20XX.XX.XX第二课时1.学会用键能、键长和键角讲明简单分子的某些性质;2.判断简单分子的构型以及稳定性。教学目标1.键能:气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键就越稳定。破坏1mol化学键形成气态基态原子所需要的最低能量。单位:kJ·mol-1键参数——键能,键长,键角键键能键键能F-F157N-O176Cl-Cl242.7N=O607Br-Br193.7O-O142I-I152.7O=O497.3C-C347.7C-H413.4C=C615O-H462.8C≡C812N-H390.8C-O351H-F568C=O745H-Cl431.8N-N193H-Br366N=N418H-I298.7N≡N946H-H436【思考】教材P34第四题N≡N的键能大于N-N的三倍,N=N大于N-N的二倍;C≡C的键能小于C-C的三倍,C=C小于C-C的二倍,说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应。而氮分子中N≡N非常牢固,所以不易发生加成反应。表2-1某些共价键键能/kJ·mol-1由下表的数据判断,下列分子的稳定性:A.Cl2,Br2,I2B.NH3,H2O键键能键键能Cl-Cl242.7N=O607Br-Br193.7O-O142I-I152.7O=O497.3O-H462.8N-H390.8练习【思考与交流】P32H2+Cl2=2HClΔH=436.0kJ·mol-1+242.7kJ·mol-1-2×431.8kJ·mol-1=-184.9kJH2+Br2=2HBrΔH=436.0kJ·mol-1+193.7kJ·mol-1-2×366kJ·mol-1=-102.7kJ因为生成HCl放出的热量高于生成HBr放出的热量,所以生成的HCl较稳定原理:∆H=反应物键能总和-生成物键能总和1.根据表2-1数据,计算1molH2分别跟1molCl2、1molBr2(蒸气)反应,分别生成2molHCl和2molHBr分子,哪个反应放出的能量多?结果又能说明什么?键H—HBr—BrCl—ClH—ClH—Br键能436.0193.7242.7431.83662、N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?从表2-1的数据可知,N-H、O-H、F-H的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。【思考与交流】P322、键长:形成共价键的两个原子之间的核间距。键长是衡量共价键稳定性的另一个参数。键长越短,一般键能越大,化学键越牢固,由该键形成的分子越稳定。3、通过上述例子,你认为键长、键能对分子的化学性质有什么影响?共价半径:相同原子的共价键键长的一半键键能键长键键能键长H-H43674H-F565.092Cl-Cl242.7198H-Cl428.0128H-Br362.0141H-I295.0161由下表的数据判断,下列分子的稳定性A.H2,Cl2B.HCl,HBr,HI练习常见分子的键角CO2_________H2O_________NH3_________CH4_________P4_________180°104.5°107.3°109°28’60°3、键角:两个共价键之间的夹角称为键角H2O105°NH3107°CO2180°CH4109º28'键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质与键角有关。+4键角决定分子的空间构型1、下列说法中,错误的是()A.键长越长,化学键越牢固B.成键原子间原子轨道重叠越多,共价键越牢固C.对双原子分子来讲,键能越大,含有该键的分子越稳定D.原子间通过共用电子对所形成的化学键叫共价键A2、能够用键能解释的是()A.氮气的化学性质比氧气稳定B.常温常压下,溴呈液体,碘为固体C.稀有气体一般很难发生化学反应D.硝酸易挥发,硫酸难挥发A练习二、键参数—键能、键长和键角键能:气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。键长:形成共价键的两个原子之间的核间距。键长越短,键能越大,化学键越稳定。键角:两个共价键之间的夹角。破坏1mol化学键形成气态基态原子所需的最低能量。应用:计算化学反应的反应热。∆H=反应物键能总和-生成物键能总和键角决定分子的空间构型。【课堂小结】感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明谢谢观看分子结构与性质SOCIALASSISTANCEFORTHEWEAK汇报人:办公资源汇报时间:20XX.XX.XX第二课时
提供《共价键》高二上册化学选修三PPT课件(第2课时).pptx会员下载,编号:1701020860,格式为 xlsx,文件大小为14页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载