人教版化学九年级下册9.3《溶液的浓度》知识总结
本作品内容为人教版化学九年级下册9.3《溶液的浓度》知识总结,格式为 doc ,大小 111656 KB ,页数为 5页
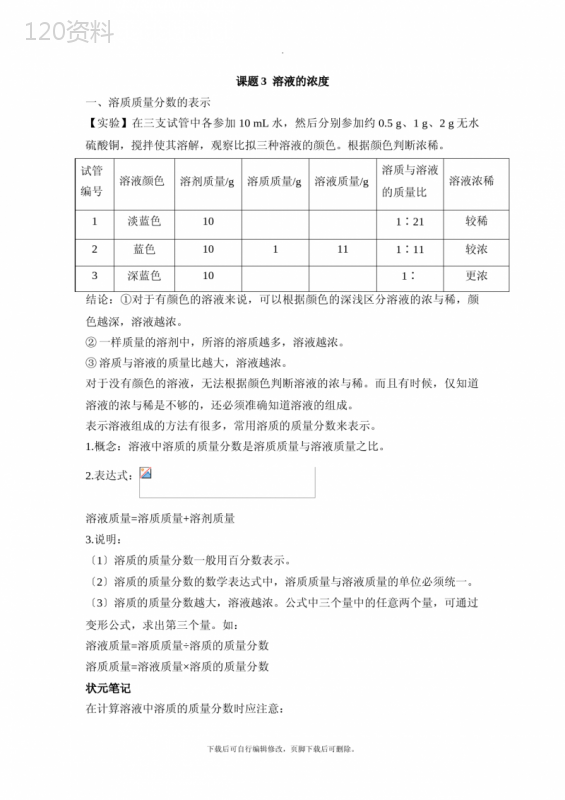
('.课题3溶液的浓度一、溶质质量分数的表示【实验】在三支试管中各参加10mL水,然后分别参加约0.5g、1g、2g无水硫酸铜,搅拌使其溶解,观察比拟三种溶液的颜色。根据颜色判断浓稀。试管编号溶液颜色溶剂质量/g溶质质量/g溶液质量/g溶质与溶液的质量比溶液浓稀1淡蓝色101∶21较稀2蓝色101111∶11较浓3深蓝色101∶更浓结论:①对于有颜色的溶液来说,可以根据颜色的深浅区分溶液的浓与稀,颜色越深,溶液越浓。②一样质量的溶剂中,所溶的溶质越多,溶液越浓。③溶质与溶液的质量比越大,溶液越浓。对于没有颜色的溶液,无法根据颜色判断溶液的浓与稀。而且有时候,仅知道溶液的浓与稀是不够的,还必须准确知道溶液的组成。表示溶液组成的方法有很多,常用溶质的质量分数来表示。1.概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。2.表达式:溶液质量=溶质质量+溶剂质量3.说明:〔1〕溶质的质量分数一般用百分数表示。〔2〕溶质的质量分数的数学表达式中,溶质质量与溶液质量的单位必须统一。〔3〕溶质的质量分数越大,溶液越浓。公式中三个量中的任意两个量,可通过变形公式,求出第三个量。如:溶液质量=溶质质量÷溶质的质量分数溶质质量=溶液质量×溶质的质量分数状元笔记在计算溶液中溶质的质量分数时应注意:下载后可自行编辑修改,页脚下载后可删除。.〔1〕溶质质量是指形成溶液的那局部溶质,没有进入溶液的溶质不在考虑范围之内。〔2〕溶液质量是该溶液中溶剂质量与全部溶解的溶质质量〔可以是一种或几种溶质〕的和。〔3〕假设告诉溶液体积时,要换算成质量,换算公式为:m=ρ×V,即质量=密度×体积。〔4〕溶质的质量分数、溶质质量、溶剂质量、溶液质量四者之间的关系:溶质质量溶剂质量溶液质量溶质的质量分数不变增加增加减少不变减少减少增大增加不变增加增大减少不变减少减少成比例增减成比例增减增加或减少不变【例如】对“10%的食盐溶液〞含义的解释错误的选项是〔〕A.100g水中溶解了10g食盐B.100g食盐溶液溶解有10g食盐C.将10g食盐溶解于90g水中所得的溶液D.将食盐与水按1∶9的质量比配成的溶液解析:“10%〞的含义是指100份质量的食盐溶液中含有10份质量的食盐,10g食盐溶解于90g水中得到的溶液为100g。答案:A【例如】500g质量分数为10%的葡萄糖溶液里,含有葡萄糖_________g,含有水_________g;假设从中取走250g葡萄糖溶液,剩余溶液中含有葡萄糖_________g,含水_________g,溶质的质量分数为_________。解析:500g10%的葡萄糖溶液中溶质质量为500g×10%=50g,溶剂质量为500g-50g=450g。由于溶液具有均一性,取走250g溶液后,剩余溶液与原溶液溶质质量分数一样,溶剂、溶质各为原来的一半。答案504502522510%二、溶液的稀释下载后可自行编辑修改,页脚下载后可删除。.使溶液的溶质质量分数减小的方法有:①参加溶剂,此方法遵循的等量关系是:稀释前溶质的质量=稀释后溶质的质量。②参加低浓度的溶液,其等量关系为:原溶液的质量+低浓度溶液的质量=混合后溶液的质量,原溶液中溶质的质量+低浓度溶液中溶质的质量=混合后溶液中溶质的质量。溶液的质量可以通过溶液的体积和密度进展计算。溶液的质量〔g〕=溶液的体积〔cm3〕×溶液的密度〔g·cm-3〕状元笔记两种不同浓度的溶液混合,混合后溶液的体积不等于二者的体积之和,但混合后溶液的质量一定等于二者的质量之和。【例如】将50g质量分数为20%的硝酸钾溶液加水稀释到200g,稀释后所得溶液中溶质的质量分数是多少?需加水的质量是多少?解析:溶液稀释前后溶质的质量不变。设稀释后所得溶液中溶质的质量分数为x。那么50g×20%=200g×x,解得x=5%。需加水的质量为200g-50g=150g答案5%150g三、溶液的配制1.用固体和水配制溶液如用食盐和水配制50g5%的氯化钠溶液。〔1〕实验步骤:①计算:按配制需要求出所需溶质和溶剂的量〔固体求出质量、液体求出体积〕。需要氯化钠的质量:50g×5%=2.5g需要水的质量:50g-2.5g=47.5g需要水的体积:47.5g÷1g·cm-3=47.5mL②称量:称量是指用天平称出固体的质量,用量筒量取液体的体积。用天平称出2.5g氯化钠,用50mL量筒量取47.5mL水。③溶解:将溶质和溶剂在烧杯中混合,搅拌至充分溶解即可。将2.5g氯化钠和47.5mL水倒入烧杯中,用玻璃棒搅拌至溶解。④装瓶保存:在试剂瓶的标签上写明药品的名称和溶质的质量分数。如下列图下载后可自行编辑修改,页脚下载后可删除。.〔2〕实验仪器:托盘天平、量筒、烧杯、玻璃棒、药匙、胶头滴管。状元笔记在做化学实验时,固体一般用天平称质量,液体一般用量筒量体积。求液体体积的公式是:体积=质量÷密度。注意单位的统一。2.用浓溶液配制稀溶液如用溶质的质量分数为37%,密度为1.18g·cm-3的浓盐酸,配制50g溶质的质量分数为5%的稀盐酸。〔1〕实验步骤:①计算:按配制需要求出所需浓盐酸的质量、体积以及所需水的质量、体积。设需要浓盐酸的质量为x37%x=50g×5%x=6.76g那么需要水的质量为50g-6.75g=43.25g浓盐酸的体积为6.76g÷1.18g·cm-3≈5.7mL水的体积为43.25g÷1g·cm-3=43.25mL≈43.3mL②量取:用适宜的量筒量取两种液体的体积。用10mL的量筒量取5.7mL37%的浓盐酸,用50mL的量筒量取43.3mL水。③配制:将两种液体混合均匀,即得要求的溶液。将量取的浓盐酸和水分别倒入烧杯中,用玻璃棒搅拌均匀。所用仪器:量筒、胶头滴管、烧杯、玻璃棒。④装瓶保存:在试剂瓶的标签上写明药品的名称和溶质的质量分数。3.实验注意的问题〔1〕称量固体时,砝码应放在右盘,物体应放在左盘。假设左右颠倒〔1克以下用游码〕,那么实际所取固体质量=砝码质量-游码质量。实际称量的物质的质量比要求的少了,配制的溶液变稀了。〔2〕要用适宜的量筒量取液体体积,读数时应平视凹液面最低处。假设俯视读数,那么读数偏大,量取液体的体积少了;假设仰视读数,那么读数偏小,量下载后可自行编辑修改,页脚下载后可删除。.取液体的体积多了。4.误差分析〔1〕所配溶液中溶质的质量分数偏大①溶质的质量偏大:称量固体溶质质量偏多或量取浓溶液时仰视读数。②溶剂质量偏少:用量筒量取水时,读数时俯视液面;或水量好后,向烧杯中倾倒时有液体洒落。〔2〕所配溶液中溶质的质量分数偏小①溶质质量偏少:称量固体溶质质量偏少;所用固体溶质不纯、不枯燥或已潮解;称量时“左码右物〞并使用游码;量取浓溶液时俯视读数。②溶剂质量偏多:量取水时仰视读数;烧杯内有残留的水。状元笔记天平和量筒是配制溶液时两种重要的仪器,一定要熟练掌握,标准操作,减小误差产生。【例如】配制一定溶质的质量分数的氯化钠溶液的一些操作步骤见下列图。正确的操作顺序是〔〕A.④⑤①②③B.①②③④⑤C.③④①②⑤D.②①④③⑤解析:配制的步骤是:计算、称量、溶解,先称量后溶解。答案:A下载后可自行编辑修改,页脚下载后可删除。',)
提供人教版化学九年级下册9.3《溶液的浓度》知识总结会员下载,编号:1700723989,格式为 docx,文件大小为5页,请使用软件:wps,office word 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载