《化学反应的限度和化学反应条件的控制》高一必修二PPT课件(第6.2.2课时).pptx




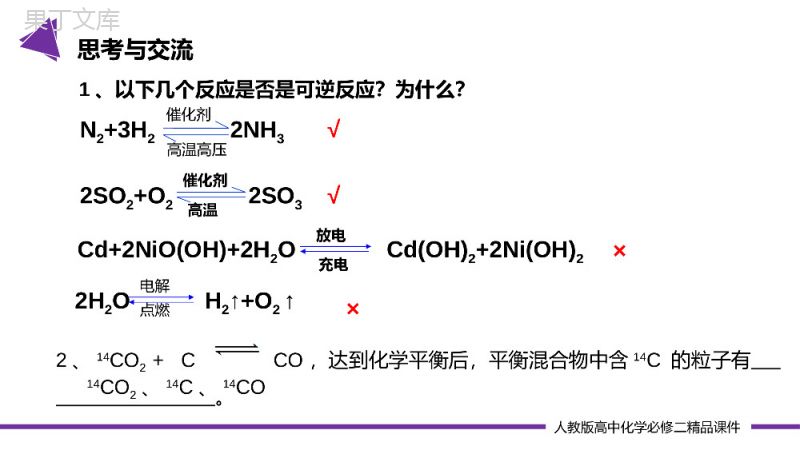
第二节化学反应速率与限度第六章化学反应与能量PleaseEnterYourDetailedTextHere,TheContentShouldBeConciseAndClear,ConciseAndConciseDoNotNeedTooMuchText第2课时化学反应的限度和化学反应条件的控制主讲人:办公资源时间:20xx.4.4LOGO人教版高中化学必修二精品课件学习目标与核心素养学习目标1、了解可逆反应。2、理解化学平衡状态和学会平衡状态的判断。3、了解控制反应条件在生产生活和科学研究中的作用。核心素养1、变化观念与平衡思想:化学反应有一定限度,是可以调控的。2、证据推理与模型认知:通过分析推理认识化学平衡的特征。人教版高中化学必修二精品课件思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?①2H2+O2=2H2O已知:2mol1mol②2SO2+O2=2SO3已知:2mol1mol2mol?<2mol?由上可知可逆反应进行得不完全,正、逆向反应同时同条件进行。化学反应物不可能全部转化为生成物,存在一定的化学反应限度。其实任何化学反应的进程都有一定的限度(可逆性),反应物不可能完全参加了反应,有些能进行地较彻底(非可逆反应),有些反应是不彻底的,甚至是可逆的(可逆反应)。引入人教版高中化学必修二精品课件1、可逆反应:在相同条件下能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。同一条件下表示方法:书写可逆反应的化学方程式时不用“===”而用“”。一、化学反应限度人教版高中化学必修二精品课件N2+3H22NH3催化剂高温高压2SO2+O22SO3催化剂高温Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2放电充电2H2OH2↑+O2↑电解点燃√×√×2、14CO2+CCO,达到化学平衡后,平衡混合物中含14C的粒子有。1、以下几个反应是否是可逆反应?为什么?思考与交流14CO2、14C、14CO人教版高中化学必修二精品课件【思考】1、反应刚开始时,v正、v逆为何值?2、随着反应的进行,反应物和生成物的浓度如何改变?速率如何变化?3、v正递减、v逆递增将导致二者之间出现什么的结果?4、在v正=v逆后,v正会继续减小吗?v逆会继续增大吗?反应物和生成物的浓度呢?在一固定容积的密闭容器里,加1molN2和3molH2(合适催化剂),能发生什么反应?2molNH3?N2+3H22NH3催化剂高温高压2、化学平衡状态的建立一、化学反应限度人教版高中化学必修二精品课件最大为零减小增大v(正)=v(逆)2、化学平衡状态的建立一、化学反应限度人教版高中化学必修二精品课件由于v(正)=v(逆)≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。从外表上看,反应好象“停止”可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态正反应速率逆反应速率相等时间速率2、化学平衡状态的建立一、化学反应限度人教版高中化学必修二精品课件3、化学平衡状态的定义:在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡状态”。化学平衡状态是可逆反应在一定条件下能达到的或完成的最大“限度”。【思考】(1)达化学平衡的反应中,如何理解正逆反应速率相等?(2)当一个可逆反应达到平衡时,各物质的浓度保持不变,这时反应停止了吗?反应速率v(正)v(逆)t1时间0可逆反应中v正=v逆是针对同一物质而言的化学反应限度决定了反应物在该条件下的最大转化率一、化学反应限度人教版高中化学必修二精品课件4、化学平衡状态的特征:逆、等、动、定、变(1)逆:讨论的对象是可逆反应(前提)(2)等:同一物质v正=v逆≠0(实质)(3)动:化学平衡是一种动态平衡。化学反应达到平衡时,反应并没有停止。(4)定:在平衡混合物中,各组成成分的含量保持不变(标志)(5)变:化学平衡状态是有条件的,当影响化学平衡的外界条件发生改变,化学平衡就会被破坏,在新的条件下建立新的化学平衡。一、化学反应限度人教版高中化学必修二精品课件1、对于可逆反应M+NQ达到平衡时,下列说法正确的是()A.M、N、Q三种物质的浓度一定相等B.M、N全部变成了QC.反应物和生成物的浓度都保持不变D.反应已经停止C2、在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡状态的标志是()A.C的生成速率和C的分解速率相等.B.单位时间内生成1molA同时生成了3molB.C.A、B、C浓度不再变化.D.A、B、C的分子个数之比为1:3:2AC课堂练习人教版高中化学必修二精品课件直接速率v(正)=v(逆)浓度不再改变vA(耗)=vA(生)等号一边一生一死,量与系数成正比等号两边同生共死,量与系数成正比各组分的浓度不再变化各组分的n/m/W(n)不再变化5、化学平衡状态的判断一、化学反应限度人教版高中化学必修二精品课件1、以3H2+N22NH3为列分析,判断下列情形是否达到平衡状态?(1)若有1molN2消耗,则有1molN2生成。(2)若有1molN2消耗,则有3molH2生成。(3)若有1molN2消耗,则有2molNH3生成。(4)若有1molN≡N键断裂,则有6molNH﹣键断裂。(5)若有1molN≡N键断裂,则有6molNH﹣键生成。(6)若反应体系中N2、H2、NH3的百分含量不变。(7)反应体系中平均相对分子质量一定。(8)若体系的体积一定,气体的密度一定。(9)若体系的体积一定,气体的压强一定。是否是是是是否是否课堂练习人教版高中化学必修二精品课件间接压强不变若m+n≠p+q一定若m+n=p+q不一定平均相对分子质量不变若m+n≠p+q若m+n=p+q一定不一定密度不变若m+n≠p+q若m+n=p+q不一定不一定颜色不变一定5、化学平衡状态的判断以mA(g)+nB(g)pC(g)+qD(g)为例一、化学反应限度人教版高中化学必修二精品课件1、可逆反应2NO2(红棕色)2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是()A.单位时间内生成nmolO2同时生成2nmolNO2B.单位时间内生成nmolO2同时生成2nmolNOC.c(NO2):c(NO):c(CO2)=2:2:1D.混合气体的颜色不再改变F.混合气体的密度不再改变E.混合气体的平均相对分子质量不再改变H.混合气体个组分的体积分数不再改变ADEH课堂练习人教版高中化学必修二精品课件2、3molA和2.5molB混合于2L的密闭容器中发生反应:3A(g)+B(g)aC(g)+2D(g),5min后达到平衡,已知v(c)=0.05mol/(min·L),生成D为1mol。下列选项正确的是()A.v(A)=0.15mol/(min·L)B.a=2C.平衡时B的转化率为20%D.平衡时压强为起始时的0.8倍C×100%AAA(A)的初始浓度-的平衡浓度α=的初始浓度课堂练习×100%AAA(A)的初始浓度-的平衡浓度α=的初始浓度人教版高中化学必修二精品课件化学平衡状态的判断依据(1)直接判断依据①v正A=v逆A>0②各物质浓度保持不变⇒达到平衡状态(2)间接判断依据以mA(g)+nB(g)pC(g)+qD(g)为例类型判断依据平衡状态混合物体系中各成分的含量①各物质的物质的量或各物质的物质的量分数一定平衡②各物质的质量或各物质的质量分数一定平衡总结①v正A=v逆A>0②各物质浓度保持不变⇒达到平衡状态人教版高中化学必修二精品课件正、逆反应速率的关系①在单位时间内消耗了mmolA同时生成mmolA,即v正=v逆平衡②在单位时间内消耗了nmolB同时生成pmolC,则v正不一定等于v逆不一定③在单位时间内生成nmolB,同时消耗qmolD,因二者变化均表示v逆,所以v正不一定等于v逆不一定温度体系温度一定(其他不变)平衡颜色反应体系内有色物质的颜色一定平衡总结人教版高中化学必修二精品课件在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。催化剂高温、高压N2+3H22NH3合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。二、化学反应条件的控制人教版高中化学必修二精品课件为提高燃料的燃烧效率,应如何调控燃烧反应的条件?(提示:可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用,等等。)①燃料与空气接触;②温度达到燃料的着火点。(2)燃料充分燃烧的条件①要有足够的空气或氧气(助燃剂);②燃料与空气或氧气要有足够大的接触面积。(3)燃料充分燃烧的意义①使有限的能量发挥最大的作用,节约能源;②降低污染程度。思考与讨论人教版高中化学必修二精品课件促进抑制总结人教版高中化学必修二精品课件1.下列关于化学反应限度的说法中正确的是()A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零C.平衡状态时,各物质的浓度保持相等D.化学反应的限度不可以通过改变条件而改变A课堂练习人教版高中化学必修二精品课件C高温、高压催化剂2.在体积不变的密闭容器中发生反应N2(g)+3H2(g)2NH3(g),下列叙述表示该反应处于化学平衡状态的是()A.N2、H2、NH3的浓度之比为1∶3∶2B.混合气体的密度不随时间变化C.当有1molN≡N键断裂时,有6molN—H键断裂D.单位时间内生成2amolNH3,同时消耗amolN2课堂练习高温、高压催化剂人教版高中化学必修二精品课件3.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法中错误的是()A.能够节约原料和能源B.能够提高产品的产量C.能够提高经济效益D.能够提高化学反应速率D4.下列措施可以提高燃料燃烧效率的是____________(填序号)。①提高燃料的着火点②降低燃料的着火点③将固体燃料粉碎④将液体燃料雾化处理⑤将煤进行气化处理⑥通入适当过量的空气③④⑤⑥课堂练习感谢您下载68素材平台上提供的PPT作品,为了您和68素材以及原创作者的利益,请勿复制、传播、销售;素材均来源于网络用户分享,故68素材不具备充分的监控能力来审查图片是否存在侵权等情节。68素材不拥有此类图片的版权,本站所有资源仅供学习与交流,不得用于任何商业用途的范围,用户应自觉遵守著作权法及其他相关法律的规定,不得侵犯本网站及权利人的合法权利,给68素材和任何第三方造成损失的,侵权用户应负全部责任。版权声明感谢各位的仔细聆听第六章化学反应与能量PleaseEnterYourDetailedTextHere,TheContentShouldBeConciseAndClear,ConciseAndConciseDoNotNeedTooMuchText第2课时化学反应的限度和化学反应条件的控制主讲人:办公资源时间:20xx.4.4LOGO
提供《化学反应的限度和化学反应条件的控制》高一必修二PPT课件(第6.2.2课时).pptx会员下载,编号:1701021124,格式为 xlsx,文件大小为26页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载