2024年新高考化学专题练习-(3)
本作品内容为2024年新高考化学专题练习-(3),格式为 docx ,大小 2550231 KB ,页数为 17页
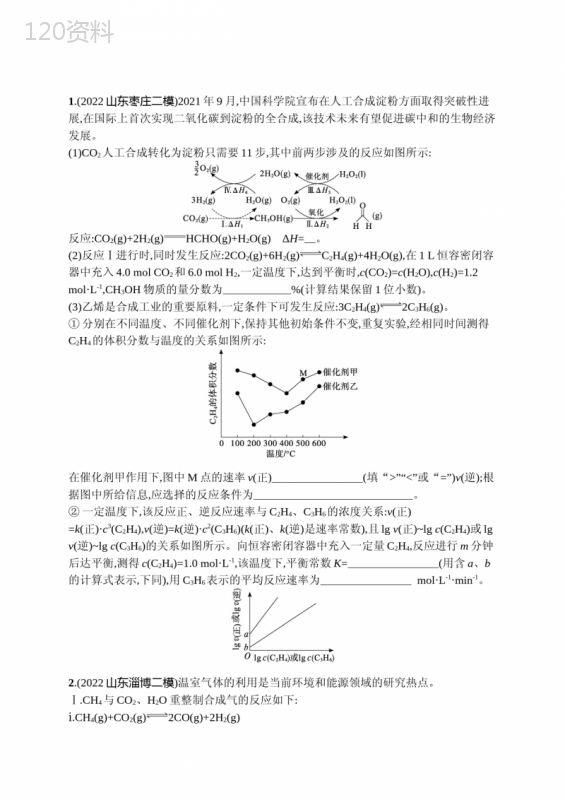
('1.(2022山东枣庄二模)2021年9月,中国科学院宣布在人工合成淀粉方面取得突破性进展,在国际上首次实现二氧化碳到淀粉的全合成,该技术未来有望促进碳中和的生物经济发展。(1)CO2人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示:反应:CO2(g)+2H2(g)HCHO(g)+H2O(g)ΔH=。(2)反应Ⅰ进行时,同时发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O),c(H2)=1.2mol·L-1,CH3OH物质的量分数为%(计算结果保留1位小数)。(3)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g)2C3H6(g)。①分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4的体积分数与温度的关系如图所示:在催化剂甲作用下,图中M点的速率v(正)(填“>”“<”或“=”)v(逆);根据图中所给信息,应选择的反应条件为。②一定温度下,该反应正、逆反应速率与C2H4、C3H6的浓度关系:v(正)=k(正)·c3(C2H4),v(逆)=k(逆)·c2(C3H6)(k(正)、k(逆)是速率常数),且lgv(正)~lgc(C2H4)或lgv(逆)~lgc(C3H6)的关系如图所示。向恒容密闭容器中充入一定量C2H4,反应进行m分钟后达平衡,测得c(C2H4)=1.0mol·L-1,该温度下,平衡常数K=(用含a、b的计算式表示,下同),用C3H6表示的平均反应速率为mol·L-1·min-1。2.(2022山东淄博二模)温室气体的利用是当前环境和能源领域的研究热点。Ⅰ.CH4与CO2、H2O重整制合成气的反应如下:ⅰ.CH4(g)+CO2(g)2CO(g)+2H2(g)ⅱ.CH4(g)+H2O(g)CO(g)+3H2(g)ⅲ.CO(g)+H2O(g)CO2(g)+H2(g)已知反应ⅱ和ⅲ的平衡常数的自然对数lnKp与温度的关系如图1所示。图1(1)ⅰ.CH4(g)+CO2(g)2CO(g)+2H2(g)ΔH(填“>”或“<”)0。(2)分别在不同压强下,向VL密闭容器中按照n(CO)∶n(CH4)∶n(H2O)=1∶1∶1投料,实验测得平衡时n(H2)n(CO)随温度的变化关系如图2所示。图2①压强p1、p2、p3由大到小的顺序为。②压强为p2时,随着温度升高,n(H2)n(CO)先增大后减小,解释原因。Ⅱ.向密闭容器中充入一定量的CH4(g)和NO(g),保持总压为100kPa发生反应:CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g)ΔH<0。已知n(NO)n(CH4)=1时NO的平衡转化率~1T、T3K下NO平衡转化率~n(NO)n(CH4)的关系曲线如图3所示。图3(3)曲线(填“Ⅰ”或“Ⅱ”)表示T3K下NO平衡转化率~n(NO)n(CH4)的关系,Tl(填“>”或“<”)T2。(4)在n(NO)n(CH4)=1、T3K下,该反应平衡时N2的体积分数为。已知:该反应的标准平衡常数Kθ=p(CO2)pθ·[p(N2)pθ]2·[p(H2O)pθ]2[p(NO)pθ]4·p(CH4)pθ,其中pθ为标准压强,pθ=100kPa,p(CH4)、p(NO)、p(CO2)、p(N2)和p(H2O)为各组分的平衡分压,则该温度下该反应的标准平衡常数Kθ=(p分=p总×物质的量分数)。3.(2022辽宁鞍山二模)水煤气变换反应可用于大规模制H2,反应原理如下:CO(g)+H2O(g)CO2(g)+H2(g)ΔH=-41.2kJ·mol-1。(1)生产中,欲既提高CO的转化率,又提高反应速率,可采取的一项措施是。(2)实验发现其他条件不变,在体系中投入一定量CaO可以增大H2的体积分数,从化学平衡的角度解释原因:。(3)在其他条件相同时,将两种等质量不同粒径的CaO(纳米级和微米级)投入体系中,H2体积分数随时间变化如图所示,其中表示纳米级CaO对H2体积分数产生影响的曲线是(填“a”或“b”),判断理由是。(4)将CaCO3加热至T℃,部分发生分解,达到平衡时Kp=p0kPa。T℃,在一真空密闭容器中加入过量的CaCO3,再充入一定量的H2,加入催化剂使其发生反应:CO2(g)+H2(g)CO(g)+H2O(g)(忽略其他副反应),测得该反应中物质分压如图所示(t时刻前,CO2的分压未给出):①A点坐标为(t,);②H2的平衡转化率为;③反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数Kp=。4.(2022湖南衡阳二模)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下:主反应:CH4(g)+CO2(g)2CO(g)+2H2(g)ΔH1副反应:CO2(g)+H2(g)CO(g)+H2O(g)ΔH2=+41.0kJ·mol-1回答下列问题:(1)已知CH4、CO和H2的燃烧热ΔH分别为-890.3kJ·mol-1、-283.0kJ·mol-1和-285.8kJ·mol-1,该催化重整主反应的ΔH1=kJ·mol-1。有利于提高CO2平衡转化率的条件是(填字母)。A.高温高压B.高温低压C.低温高压D.低温低压(2)在刚性密闭容器中,进料比n(CO2)n(CH4)分别等于1.0、1.5、2.0,且反应达到平衡状态。图甲图乙①甲烷的质量分数随温度变化的关系如图甲所示,曲线c对应的n(CO2)n(CH4)=;②反应体系中,n(H2)n(CO)随温度变化的关系如图乙所示,随着进料比n(CO2)n(CH4)的增加,n(H2)n(CO)的值(填“增大”“不变”或“减小”),其原因是。(3)在800℃、101kPa时,按投料比n(CO2)n(CH4)=1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的压强平衡常数Kp=(计算结果保留3位有效数字)。(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气CO和H2,同时获得甘油醛。则催化电极a为极,催化电极b产生CO的电极反应式为。图丙5.(2022湖北黄冈二模)苯是一种重要的工业原料,可利用环己烷脱氢制取。环己烷脱氢制苯的反应过程如下:①(g)(g)+H2(g)ΔH1=akJ·mol-1②(g)(g)+2H2(g)ΔH2=bkJ·mol-1③(g)(g)+3H2(g)ΔH3>0(1)则反应③的ΔH3为(用含a、b的代数式表示),有利于提高上述反应③的平衡转化率的条件是(填字母)。A.高温高压B.低温低压C.高温低压D.低温高压(2)不同压强和温度下反应③的平衡转化率如图甲所示。图甲Ⅰ.在相同压强下升高温度,未达到新平衡前,v(正)(填“大于”“小于”或“等于”)v(逆)。Ⅱ.研究表明,既升高温度又增大压强,C6H12的平衡转化率也升高,理由可能是。(3)T℃向2L的密闭反应器中充入1molC6H12进行催化脱氢,测得C6H10和C6H6的产率x1和x2(以物质的量分数计)随时间的变化关系如图乙所示。在8min时,反应体系内氢气的物质的量为mol(忽略其他副反应)。0~8min内C6H6的平均化学反应速率为。反应③的化学平衡常数K=(只代入数据即可,不需要计算结果)。图乙6.(2022山东泰安三模)清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。图甲芳构化反应:(g)→(g)+3H2(g)ΔH=kJ·mol-1。(2)H2和CO2合成乙醇的反应为2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。图乙图丙①压强p1(填“>”“=”或“<”,下同)p2,a、b两点的平衡常数KaKb。②已知Arrhenius经验公式为Rlnk=-EaT+C(Ea为活化能,k为速率常数,R和C为常数)。为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=J·mol-1。从图中信息获知催化效能较高的催化剂是(填“m”或“n”),判断理由是。(3)H2和CO合成甲烷反应为2CO(g)+2H2(g)CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v(逆)=k(逆)p(CH4)·p(CO2),其中p为分压,该温度下k(逆)=5.0×10-4kPa-1·s-1。反应达平衡时测得v(正)=516kPa·s-1。CO的平衡转化率为,该温度下反应的Kp=(用组分的分压计算的平衡常数)。7.(2022河北石家庄二模)甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以CO2、H2为原料制备甲醚涉及的主要反应如下:Ⅰ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)ΔH1<0Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g)ΔH2回答下列问题:(1)将CO与H2O混合气体置于绝热恒容密闭容器中发生反应Ⅱ,逆反应速率随时间变化的趋势如图所示(不考虑催化剂的影响)。则ΔH2(填“>”或“<”)0;a、b、c三点对应反应体系温度Ta、Tb、Tc由高到低的顺序为。(2)在恒压条件下,按CO2与H2的物质的量之比为1∶3投料,测得CO2平衡转化率和平衡时CO的选择性(转化的CO2中生成CO的物质的量分数)随温度的变化曲线如图所示。①曲线n随温度升高显示如图所示的变化趋势的原因是。②T℃时反应Ⅱ的平衡常数K=(保留两位有效数字);合成甲醚的适宜温度为260℃,理由是。③其他条件不变,改为恒容条件,CO平衡选择性比恒压条件下的平衡选择性(填“高”“低”或“不变”)。8.(2022广东汕头二模)CO2是一种温室气体,CO2的产生会影响人类生存的环境,将CO2作为原料转化为有用的化学品,对实现碳中和及生态环境保护有着重要意义。Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:(1)液相中,合成尿素的热化学方程式为2NH3(l)+CO2(l)H2O(l)+NH2CONH2(l)ΔH=kJ·mol-1。(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)ΔH<0。下列说法正确的是(填字母)。A.增大CO2的浓度,有利于NH3的转化率增大B.反应在任何温度下都能自发进行C.当混合气体的密度不再发生改变时反应达平衡状态D.充入He,压强增大,平衡向正反应方向移动Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1L的密闭容器中,充入等物质的量的CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g)。(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3mol·L-1,则CH4的转化率为(保留2位有效数字)。(4)制备“合成气”反应历程分两步:步骤反应正反应速率方程逆反应速率方程反应①CH4(g)C(ads)+2H2(g)v(正)=k1·c(CH4)v(逆)=k2·c2(H2)反应②C(ads)+CO2(g)2CO(g)v(正)=k3·c(CO2)v(逆)=k4·c2(CO)上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:①反应速率快慢比较:反应①(填“>”“<”或“=”)反应②,请依据有效碰撞理论微观探析其原因。②一定温度下,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数K=(用k1、k2、k3、k4表示)。参考答案大题突破练3化学反应原理综合题1.答案(1)ΔH1+ΔH2+12ΔH3+13ΔH4(2)11.1(3)①>催化剂乙、反应温度200℃②10a-b10a-b2m解析(1)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1,反应Ⅱ:CH3OH(g)+O2(g)HCHO(g)+H2O2(l)ΔH2,反应Ⅲ:2H2O2(l)2H2O(g)+O2(g)ΔH3,反应Ⅳ:3H2O(g)32O2(g)+3H2(g)ΔH4。根据盖斯定律,由反应Ⅰ+Ⅱ+12×Ⅲ+13×Ⅳ可得反应:CO2(g)+2H2(g)HCHO(g)+H2O(g)ΔH=ΔH1+ΔH2+12ΔH3+13ΔH4。(2)设平衡时CH3OH物质的量为xmol,C2H4物质的量为ymol,列三段式:容器容积为1L,达到平衡时,c(CO2)=c(H2O),则4-x-2y=x+4y①,c(H2)=1.2mol·L-1,则6-3x-6y=1.2②,联立①②式解得x=0.8、y=0.4,则CH3OH物质的量分数为0.82.4+1.2+0.8+2.4+0.4×100%≈11.1%。(3)①催化剂不能使平衡发生移动,由题图可知M点乙烯的转化率低于同温度下催化剂为乙时乙烯的转化率,说明M点时反应还没有达到平衡状态,反应还向正反应方向进行,故v(正)>v(逆);根据题图中所给信息,催化剂为乙的时候乙烯的转化率高,故应选择的反应条件为催化剂乙、反应温度200℃。②由化学方程式3C2H4(g)2C3H6(g)可知,正反应速率与乙烯的浓度有关,逆反应速率与丙烯的浓度有关,由速率公式可得:lgv(正)=lgk(正)+3lgc(C2H4),lgv(逆)=lgk(逆)+2lgc(C3H6),故lgv(正)的斜率更大一些,由题图可知当lgc(C2H4)和lgc(C3H6)均为0时,lgv(正)=a,lgv(逆)=b,则lgv(正)=lgk(正)=a,k(正)=10a,lgv(逆)=lgk(逆)=b,k(逆)=10b,则T℃时,该反应达到平衡时,v(正)=v(逆),即k(正)c3(C2H4)=k(逆)c2(C3H6),则平衡常数K=c2(C3H6)c3(C2H4)=k()正k()逆=10a10b=10a-b;设向容器中充入xmol·L-1C2H4,平衡后测得c(C2H4)=1.0mol·L-1,列出三段式:则平衡常数K=c2(C3H6)c3(C2H4)=[23(x-1.0)]21.03=10a-b,解得:23(x-1.0)=10a-b2,则用C3H6表示的平均反应速率为v(C3H6)=Δc(C3H6)Δt=23(x-1.0)mmol·L-1·min-1=10a-b2mmol·L-1·min-1。2.答案(1)>(2)①p3>p2>p1②升高温度,反应ⅰ、ⅱ平衡均正向移动,反应ⅲ平衡逆向移动,T
提供2024年新高考化学专题练习-(3)会员下载,编号:1700737283,格式为 docx,文件大小为17页,请使用软件:wps,office word 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载