医疗器械不良事件监测管理制度,医疗器械不良事件监测管理制度汇编
本作品内容为医疗器械不良事件监测管理制度,格式为 docx ,大小 122374 KB ,页数为 9页
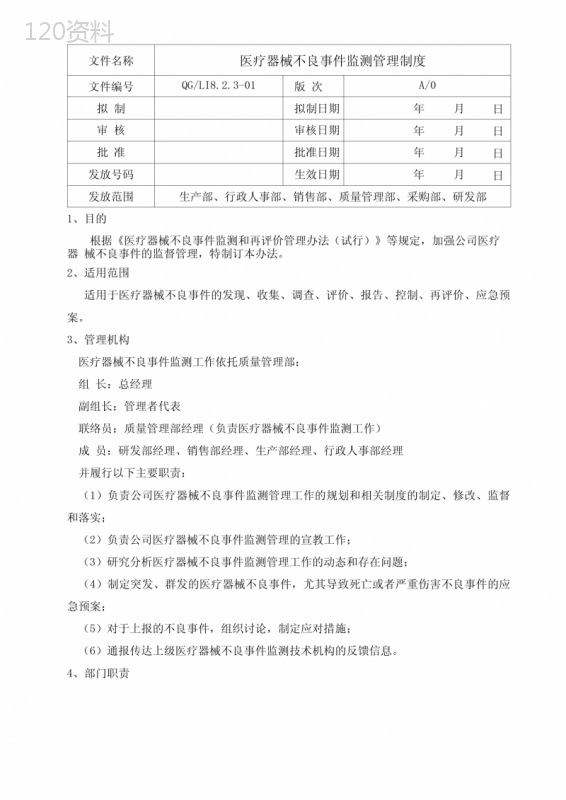
("文件名称医疗器械不良事件监测管理制度文件编号QG/LI8.2.3-01版次A/0拟制拟制日期年月日审核审核日期年月日批准批准日期年月日发放号码生效日期年月日发放范围生产部、行政人事部、销售部、质量管理部、采购部、研发部1、目的根据《医疗器械不良事件监测和再评价管理办法(试行)》等规定,加强公司医疗器械不良事件的监督管理,特制订本办法。2、适用范围适用于医疗器械不良事件的发现、收集、调查、评价、报告、控制、再评价、应急预案。3、管理机构医疗器械不良事件监测工作依托质量管理部:组长:总经理副组长:管理者代表联络员:质量管理部经理(负责医疗器械不良事件监测工作)成员:研发部经理、销售部经理、生产部经理、行政人事部经理并履行以下主要职责:(1)负责公司医疗器械不良事件监测管理工作的规划和相关制度的制定、修改、监督和落实;(2)负责公司医疗器械不良事件监测管理的宣教工作;(3)研究分析医疗器械不良事件监测管理工作的动态和存在问题;(4)制定突发、群发的医疗器械不良事件,尤其导致死亡或者严重伤害不良事件的应急预案;(5)对于上报的不良事件,组织讨论,制定应对措施;(6)通报传达上级医疗器械不良事件监测技术机构的反馈信息。4、部门职责医疗器械不良事件监测工作,总经理为公司医疗器械不良事件监测工作总负责人。质量管理部承担对不良事件进行调查与评价,并对不良事件报告评定处理的过程及结果验证,并监督纠正或预防措施的实施。4.2销售部负责不良事件信息的发现、收集。4.3总经理负责相关审批。4.4行政人事部负责医疗器械不良事件的档案管理。5、相关定义5.1医疗器械不良事件:是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。5.2医疗器械不良事件监测:指对医疗器械不良事件的发现、报告、评价和控制的过程。5.3医疗器械不良事件按照事件后果可分为一般医疗器械不良事件和严重医疗器械不良事件。严重医疗器械不良事件,是指事件后果有下列情况之一者:(一)导致死亡;(二)危及生命;(三)导致机体功能的永久性伤害或者机体结构的永久性损伤;(四)必须采取医疗措施才能避免上述永久性伤害或者损伤;(五)由于医疗器械故障、可用性等问题可能导致上述所列情况的。上述情形之外的医疗器械不良事件为一般医疗器械不良事件。6、工作程序6.1医疗器械不良事件的发现与收集销售部通过与用户联系,也可通过电话、传真、网络反馈的用户投诉及收集国内外监管部门发布的有关信息等渠道,方便用户提供医疗器械不良事件及时跟踪上市产品所有可疑的不良事件。应详细填写《可疑医疗器械不良事件收集记录表》并将结果及时反馈给质量管理部。6.2产品的隔离在正式调查结果没有公布之前,质量管理部应即刻起对该批产品进行封存和隔离,同时向公司总经理汇报。6.3医疗器械不良事件的调查和评价质量管理部负责按轻重缓急对不良事件进行分析、调查和评价,以确定是否为不良事件。在正式调查结果没有公布之前,质量管理部应即刻起对该批产品进行封存和隔离,同时向公司总经理汇报。对需要以个案形式上报的严重不良事件,在尚未查明原因前,应根据事件的严重程度、发生频率、涉及产品数量、销售区域和使用人群等情况,立即采取暂停销售和/或使用等合理有效的控制措施,并应积极配合医疗卫生机构对已造成伤害的人员进行救治。1)公司自查。质量管理部按照医疗器械质量管理体系的相关要求,重点对不良事件涉及产品的设计、原材料、生产工艺和过程、质量检验记录、销售情况、涉及产品或同类产品不良事件监测情况和文献报道等情况进行回顾性分析,找出设计研发、生产、流通和使用等环节可能存在的问题因素。2)现场调查。公司应安排人员到事件发生现场对患者情况(原患疾病、相关体征及各种检查数据、治疗情况、不良事件后果、出现不良事件的时间及地点、救治措施、转归情况等)、产品使用情况(目的、使用依据、使用人员的操作过程、相同或同批次产品的其他用户的情况、安装储存环境、维护和保养情况、使用期限等)进行调查。3)留样检测。5.4产品的召回经调查如属于医疗器械不良事件,按照风险评估的结论,必要时,启动医疗器械召回控制程序采取召回措施。5.5医疗器械不良事件的报告对于不良事件,质量管理部应在规定时限内完成医疗器械不良事件评估报告,上报总经理审批,即可进行上报。一般医疗器械不良事件应当在发现或获知之日起30日内报告。5.5.1个案报告(可疑医疗器械不良事件报告)导致死亡的可疑医疗器械不良事件,公司应于发现或者知悉之日起5个工作日内,质量管理部负责填写《可疑医疗器械不良事件报告表》,并向石家庄市药品评价检测中心报告。导致严重伤害、可能导致严重伤害或死亡的可疑医疗器械不良事件,公司应于发现或者知悉之日起15个工作日内,填写《可疑医疗器械不良事件报告表》向石家庄市药品评价检测中心报告。如认为可疑医疗器械不良事件报告中的事件发生原因分析已是最终分析结果,应在《可疑医疗器械不良事件报告表》中声明该报告为最终报告。无需补充报告。5.5.2突发、群发医疗器械不良事件报告局医疗器械监管处、河北省卫计委和河北省药品评价检测中心报告,并在24小时内填写并报送《可疑医疗器械不良事件报告表》。5.5医疗器械不良事件的补充报告5.5.1公司在提交可疑医疗器械不良事件报告后,质量管理部应综合企业信息、事件跟踪信息和产品信息等有关资料,并针对事件的后续处理、调查情况、事件发生原因以及可疑医疗器械不良事件报告中未说明的情况,填报《医疗器械不良事件补充报告表》。在提交可疑医疗器械不良事件报告后的20个工作日内,质量管理部填写《医疗器械不良事件补充报告表》,向河北省药品评价检测中心报告。5.5.2接到要求提交可疑医疗器械不良事件相关补充信息的书面通知后,医疗器械生产企业应按照通知具体要求和时限及时提交补充信息。5.5.3经调查如属于临床使用不当造成的,不属于医疗器械不良事件范畴,质量管理部应当详细记录有关情况,完成调查报告并可作为补充报告的附件上报河北省药品监测中心。5.6纠正和预防措施。完成产品的召回后,质量管理部确定是否需要启动纠正和预防措施,如需启动,质量管理部按《纠正和预防措施控制程序》实施。5.7年度评估报告公司应当自产品注册批准后,每年度撰写定期安全性评估报告留存,直至产品注册证失效。5.7医疗器械不良事件再评价5.7.1再评价启动条件(1)发现和收集到不良事件和投诉时。(2)在设计回顾性研究,质量体系自查和产品阶段性风险分析获悉存在安全隐患时。(3)食品药品监督管理部门提出要求的5.7.2再评价程序1)收集和发现。符合再启动条件的不良事件,质量管理部应填写《可疑医疗器械不良事件收集记录表》。2)产品的隔离在正式调查结果没有公布之前,质量管理部应即刻起对该批产品进行封存和隔离,同时向公司总经理汇报。3)制定评估方案。质量管理部制定评估方案。4)调查评估。公司自查。针对再评估情况,质量管理部按照医疗器械质量管理体系的相关要求,重点对不良事件涉及产品的设计、原材料、生产工艺和过程、质量检验记录、销售情况、涉及产品或同类产品不良事件监测情况和文献报道等情况进行回顾性分析,找出设计研发、生产、流通和使用等环节可能存在的问题因素。现场调查。公司应安排人员到事件发生现场对患者情况(原患疾病、相关体征及各种检查数据、治疗情况、不良事件后果、出现不良事件的时间及地点、救治措施、转归情况等)、产品使用情况(目的、使用依据、使用人员的操作过程、相同或同批次产品的其他用户的情况、安装储存环境、维护和保养情况、使用期限等)进行调查。必要时对留样样检测。质量管理部根据调查评估情况,完成评估报告,报总经理批准。5)纠正预防措施。质量管理部按照《纠正与预防控制程序》,采取纠正与预防措施。将已经知悉可能发生的医疗器械不良事件通过产品说明书等随附文件予以明示。对已确认的可能危及人身安全的缺陷,应当采取培训以及警示、检查、修理、重新标签、修改并完善说明书、软件升级、替换、收回、销毁等召回措施。6)上报评估报告。质量管理部负责将评估报告上报给河北省食品药品监督管理局。6、医疗器械不良事件档案管理6.1建立档案。行政人事部负责建立产品监测档案,保存医疗器械不良事件监测记录。记录包括:《可疑医疗器械不良事件报告表》、《医疗器械不良事件补充报告表》、《医疗器械不良事件年度汇总报告表》、医疗器械不良事件发现、收集、调查、报告和控制过程中的其他有关文件记录(如分析评价过的,用于确定该不良事件是否值得报告的有关信息在准备年度报告过程中的任何分析评价过的信息、能够确保获得的有关信息可以协助质量管理部采取进一步行动的证明文件及提交给质量管理部的其他报告和信息等)。6.2保存年限。记录应当保存至医疗器械标明的使用期后2年,但是记录保存期限应当不少于5年。7、相关文件《纠正和预防措施控制程序》《医疗器械召回控制程序》8、相关记录8.1《可疑医疗器械不良事件报告表》8.2《医疗器械不良事件补充报告表》医疗器械不良事件控制程序流程图''E质量管理部个案报告导致死亡可能导致严重伤害或死亡可疑医疗器械不良事件调查和评河北省食品药品监督管理局医疗器械监管处、河北省卫计委和河北省药品评价检测中心报告石家庄市药品评价检测中心报告突发、群发医疗器械不良事件报告质量管理部I_________!销售部可疑医疗器械不良事件收集记录表_一般不良事件5个工作日15个工作日内30日内报告可疑医疗器械不良事件报告表不良事件的补充报告质量管理部।_________1医疗器械不良事件补充报告河北省药品评价检测中心报告为质量管理部।______!建立档案质量管理部医疗器械不良事件年度汇总报告表(所有销售部可疑医疗器械不良事件收集记录表医疗器械不良事件调查和评估报告医疗器械不良事件年度汇总报告表(所有报告)QR/HLI8.2.3-03版本号:A/0报告日期:年月日编码:□□□□□□□□□□□报告来源:口生产企业口经营企业口使用单位单位名称:联系地址:邮编:联系电话:A.患者资料C.医疗器械情况1.姓名:2.年龄:3.性别男女11.产品名称:4.预期治疗疾病或作用:12.商品名称:13.注册证号:B.不良事件情况14.生产企业名称:生产企业地址:企业联系电话:5.事件主要表现:6.事件发生日期:年月日7.发现或者知悉时间:年月日15.型号规格:产品编号:产品批号:8.医疗器械实际使用场所:医疗机构家庭其他(请注明):16.操作人:专业人员非专业人员患者其他(请注明):9.事件后果死亡_______________________________(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能结构永久性损伤;需要内、外科治疗避免上述永久损伤;其他(在事件陈述中说明)。17.有效期至:年月日18.生产日期:年月日19.停用日期:年月日20.植入日期(若植入):年月日10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)21.事件发生初步原因分析:22.事件初步处理情况:23.事件报告状态:已通知使用单位已通知生产企业已通知经营企业已通知药监部门D.关联性评价(1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序?是口否口(2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是口否口不清楚口(3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释?是口否口不清楚口评价结论:很可能口可能有关口可能无关口无法确定口E.不良事件评价24.省级监测技术机构评价意见(可另附附页):25.国家监测技术机构评价意见(可另附附页):报告人:医师口技师口护士口其他口报告人签名:A.企业信息1.企业名称4.传真2.企业地址5.邮编3.联系人6.电话7.事件涉及产品:B.事件跟踪信息(至少包括:患者转归、调查分析及控制措施)C.产品信息请依次粘贴或装订下列材料(要求采用44纸张):1.医疗器械生产许可证复印件(境内企业);2.医疗器械产品注册证复印件;3.医疗器械产品标准;4.医疗器械检测机构出具的检测报告;5.产品标签;6.使用说明书;7.产品年产量、销量;8.用户分布及联系方式;9.本企业生产同类产品名称及临床应用情况。D.监测技术机构评价意见省级监测技术机构评价意见(可另附附页)国家监测技术机构评价意见(可另附附页)QR/LI8.2.3-04版本号A/0编码:□□□□□□□□□□□报告时间:年月日首次报告时间:年月日报告人:省级监测技术机构接收日期:生产企业(签章)国家监测技术机构接收日期:",)
提供医疗器械不良事件监测管理制度,医疗器械不良事件监测管理制度汇编会员下载,编号:1700818951,格式为 docx,文件大小为9页,请使用软件:wps,office word 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载