第六章-金属专项训练-2022-2023学年科粤版九年级化学-

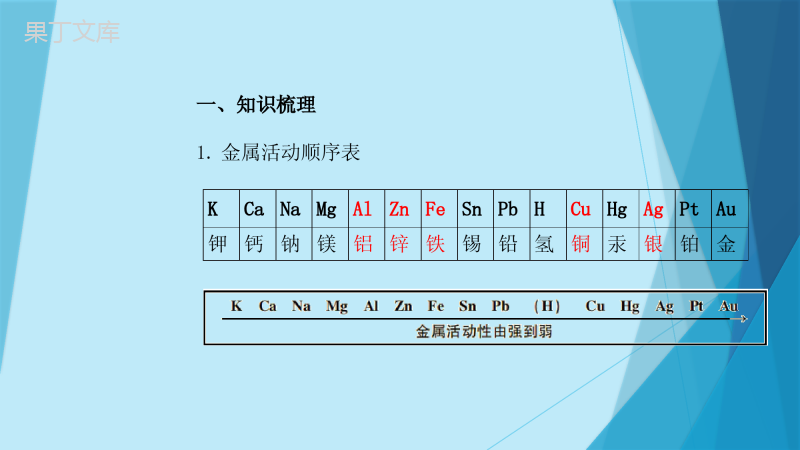

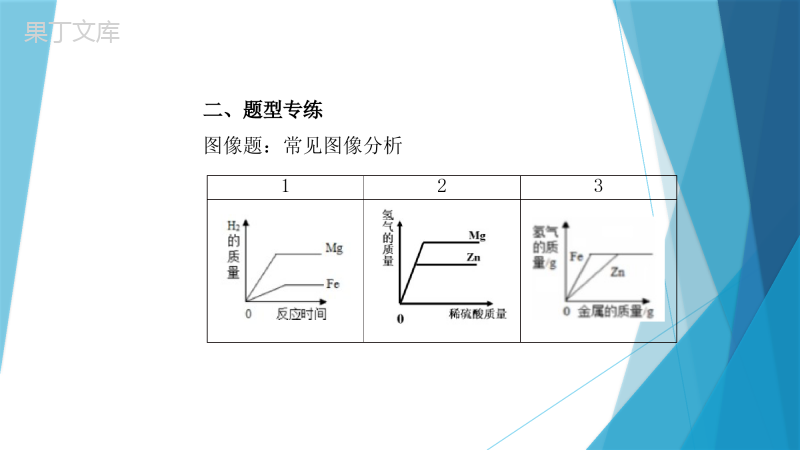

必考模块二金属专项训练一、知识梳理1.金属活动顺序表KCaNaMgAlZnFeSnPbHCuHgAgPtAu钾钙钠镁铝锌铁锡铅氢铜汞银铂金2.金属的化学性质(1)2Al+3H2SO4=Zn+H2SO4=Fe+H2SO4=Fe+2HCl=(2)Zn+Cu(NO3)2=Zn+2AgNO3=Fe+CuSO4=Fe+2AgNO3=Cu+2AgNO3=Al2(SO4)3+3H2↑ZnSO4+H2↑FeSO4+H2↑FeCl2+H2↑Zn(NO3)2+Cu2Ag+Zn(NO3)2FeSO4+CuFe(NO3)2+2AgCu(NO3)2+2Ag(与O2、酸、盐溶液反应)二、题型专练图像题:常见图像分析123例1将颗粒大小相同的等质量X、Y、Z三种金属放入等浓度的稀盐酸中,产生氢气质量如图所示,下列说法正确的是()A.金属X最活泼B.金属Y的相对原子质量一定大于XC.若金属Z是Fe,则金属X一定是AlD.金属Z反应掉的稀盐酸一定最少D变式训练1(2019江西)下列图像能正确反映对应变化关系的是()DA.向一定量的稀硫酸中逐滴加入氢氧化钙溶液B.向等质量的铝、锌中分别加入足量的等浓度稀盐酸C.完全分解等质量等浓度的过氧化氢溶液D.一定量的镁在过量的氧气中充分燃烧例2将一定质量的铝粉和锌粉加入到硝酸铜溶液中,充分反应后过滤,得到滤渣和滤液。下列说法正确的是()A.若滤液为蓝色,则滤渣中定有锌和铜B.若滤渣中加盐酸没有气泡产生,则滤液一定为无色C.若滤液中有硝酸锌,则滤渣中一定没有铝和锌D.若滤渣中加盐酸有气泡产生,则滤渣中一定有锌和铜D变式训练2(2019青岛改编)将铜粉和铁粉的混合物mg放入烧杯中,向烧杯中不断加入FeCl3溶液,测得烧杯中剩余固体的质量与加入FeCl3溶液体积的关系如下图所示。下列相关说法正确的是()【小资料】铁和铜都能与FeCl3溶液发生反应,反应的化学方程式为:Fe+2FeCl3=3FeCl2;Cu+2FeCl3=2FeCl2+CuCl2BA.FeCl3与Cu发生的化学反应属于置换反应B.铜粉和铁粉的混合物中,铁粉的质量为(m-n)gC.N点对应的溶液中一定只含Fe2+、Cu2+D.当加入V1mLFeCl3溶液时,Cu恰好完全反应流程图例3某化学实验室从含少量硝酸锌的硝酸银废液中提取贵金属Ag,其主要操作流程如图:(1)步骤Ⅰ的实验操作中,玻璃棒的作用是_______。(2)步骤Ⅱ中发生的化学反应方程式______________________。(3)由上述实验可得出锌、银、氢由强到弱的活动性顺序为_______________。(4)若往溶液D中加入足量某物质,可得到只含一种溶质的溶液,则该物质可能是________。引流Zn+H2SO4=ZnSO4+H2↑锌>氢>银ABCD变式训练3做完木炭还原氧化铁实验后的混合物中含有铁、氧化铁和木炭粉,某化学兴趣小组同学对该混合物进行如下实验,以获得FeSO4晶体。已知:Fe2(SO4)3+Fe=3FeSO4请回答:(1)操作Ⅰ的名称是________。(2)步骤①中发生复分解反应的化学方程式是___________________________。(3)步骤②中加入过量铁粉的目的是_____________________________________________。Fe2O3+3H2SO4=Fe2(SO4)3+3H2O过滤将过量的稀硫酸和硫酸铁全部转为硫酸亚铁变式训练4对废旧手机回收利用可节约金属资源。某手机电路板中含有以下金属:Ni(镍)、Pb(铅)、Ag、Au、Fe、Cu、Sn(锡)、Pd(钯)。如图是某工厂设计的回收金属流程图(假设流程图中各反应均恰好完全反应。已知2Cu+O2+2H2SO4=2CuSO4+2H2O)。(1)步骤②中反应的基本类型是________反应。(2)滤渣2中含有的金属是_____________(填化学式)。(3)步骤⑤反应的化学方程式为____________________。置换NiSnPbFe+CuSO4=FeSO4+Cu金属活动顺序例4(2016陕西真题选择)锰和镍(Ni)都是重要的金属,将镍丝插入MnSO4溶液中,无明显现象,插入CuSO4溶液中,镍丝表面有红色固体析出,则Mn、Ni、Cu三种金属的活动性由强到弱的顺序是()A.Mn、Ni、CuB.Mn、Cu、NiC.Ni、Mn、CuD.Cu、Mn、NiA例5小雨同学在探究Al、Fe、Cu三种金属的活动性实验中,设计方案如图:(1)B试管中观察到的实验现象有_________________________________________。(2)A试管中小雨在很长时间内都未观察到预期的实验现象,其原铁丝表面有红色固体生成,溶液颜色变浅铝丝表面有一层氧化膜(3)实验成功后,小雨把两支试管中所有物质合并倒入烧杯中,充分反应后,烧杯中仍有不溶性固体,为此,小雨继续展开探究。【提出问题】不溶性固体中含有哪些成分?【实验并得出结论】过滤,向滤出的不溶性固体滴加足量的稀硫酸,有气泡冒出,一定发生反应的化学方程式是____________________,该不溶性固体中一定含有的物质是____________。Fe+H2SO4=FeSO4+H2↑Fe、Cu【反思与评价】①小雨同学用表面积相等的以上三种金属片分别与等浓度等体积的稀盐酸反应完成同样的探究,却意外发现铁片中加稀盐酸后,溶液变为黄色,用化学方程式解释溶液变黄的原因_____________________。②小雨的探究实验还可以使用两种金属和同一种盐溶液,该溶液是_____溶液。【拓展应用】小雨实验结束后,将废液集中,经检测其中盐酸过量,还需处理至pH=7后排放,处理废液时除需pH试纸外可供选择的下列物质中的是_______(填序号)。a.NaOH溶液b.AgNO3溶液c.NaHCO3溶液d.生石灰Fe2O3+6HCl=2FeCl3+3H2OFeSO4acd变式训练5(1)(2013陕西真题填空节选)在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是_______________________________(填一种即可)。(2)(2010陕西真题填空节选)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是________________________。稀硫酸、硫酸铜溶液、硫酸铝溶液等硫酸铝和硫酸铜变式训练6(2012陕西真题填空)下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:(1)描述A中的实验现象:________________________________。(2)写出C中反应的化学方程式:___________________________。(3)要证明Cu,Fe,Ag的活动性顺序,至少要做的实验是_______(填序号)。(4)开始反应后D中溶液逐渐变为黄色,原因是:有白色固体生成,溶液由无色变成蓝色ABZn+2HCl=ZnCl2+H2↑铁钉表面有铁锈生成一、知识梳理1.金属物理性质(1)金属单质:共性:延展性、导热性、导电性特性:密度,硬度,熔点(2)合金相比于同种金属单质的的性质:硬度大,熔点低,绝大多数耐腐蚀金属单质和合金均属于金属材料2.金属的冶炼常见还原剂:CCOH2常见反应方程式:3CO+Fe2O3高温2Fe+3CO23C+2Fe2O3高温4Fe+3CO2↑4CO+Fe3O4高温3Fe+4CO2CO+CuO△Cu+CO2H2+CuO△Cu+H2O3.金属的腐蚀与防护腐蚀:Fe氧气和水的共同作用,铁锈的成分为Fe2O3Cu生锈的条件氧气、二氧化碳和水的共同作用例6(1)(2018年真题选择)“宏观辨识与微观探析”是化学学科的核心素养之一。对下列事实或做法的解释正确的是()A.铁质水龙头表面镀铬可防锈——改变了金属的内部结构B.众人拾柴火焰高——可燃物越多,着火点越低,越易燃烧C.用明矾净水——明矾可降低水中钙、镁离子的含量D.氧气能被液化贮存于钢瓶——分子间有间隔且间隔能改变D(2)实验室用如图装置模拟炼铁。下列说法正确的是()CA.磁铁矿的主要成分是Fe2O3B.应先加热Fe2O3,再通入COC.红棕色的Fe2O3逐渐变黑D.气体通过澄清石灰水后可直接排放(3)中考结束,你即将离开母校,离别之际,应给母校留下美好印象,做到爱护学校的一草一木,不乱仍东西…假设你在清理寝室时,清理出如下物品:A、废作业本,B、矿泉水瓶,C、易拉罐,D、霉变的蛋糕,E、生锈的铁钉.上述垃圾物品中,应放入“可回收垃圾箱”的是_______(填字母);回收的目的在于变废为宝,可回收物品是一种物品经过简单的物理方法或化学方法处理即可重新利用,如果用化学方法处理,写出有关的化学方程式_________________________。ABCEFe2O3+6HCl=2FeCl3+3H2O(4)某化学兴趣小组进行铁锈蚀条件的探究实验。①实验中通过对比______(填序号)试管中的现象,证明铁生锈需要氧气。生活中为了防止铁栏杆生锈,常采取的防锈措施是__________(写一种)。②为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。大部分合金与组成的纯金属相比,具有_______________________________的特性(写一条)。涂漆AB熔点低/耐腐蚀/硬度大二、综合性练习1.人类社会的发展离不开金属材料。如图是某硬铝的主要成分及相关实验。(1)将未打磨过的硬铝放入足量稀硫酸中,整个过程中的实验现象是______(填字母)。A.先无气泡产生,后有大量气泡产生B.立即产生大量气泡C.无气泡产生(2)将打磨过硬铝片放入硫酸铜溶液中,写出涉及到的一个化学反应的方式:_______________________________。(3)将一定量硝酸银溶液滴入盛放有硬铝粉末的试管中,充分反应后,过滤,得到滤渣和滤液。若滤渣中加入稀盐酸无气泡产生,则滤渣中一定含有的金属是_________。A2Al+3CuSO4=Al2(SO4)3+3CuAg2.成功着陆月球背面的“嫦娥四号”探测器使用了多种材料。(1)探测器上的五星红旗含有一种聚酰亚胺的有机高分子材料。该材料属于_________(填”金属”或“合成”)材料。(2)探测器使用的铝合金硬度比纯铝的硬度________(填“大”或”小”)。合成大(3)探测器广泛使用了Al、Fe、Cu.利用它们完成如下实验:①将未打磨的铝片放入FeSO4溶液中,没有明显现象②将打磨过的铝片放入FeSO4溶液中,铝片表面有明显变化③将打磨过的铁片放入CuSO4溶液中,铁片表面变红实验①中无现象是因为铝片表面有一层致密的_______(填化学式)薄膜。实验②中发生反应的化学方程式为_________________________________。Al2O32Al+3FeSO4=Al2(SO4)3+3Fe浅绿3.金属在生产和生活中具有广泛的应用。(1)冬天取暖用的暖气片有铸铁材料、铜铝材料等多种。这主要利用了金属的__________性。(2)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收ZnSO4和关金属,流程如图:导热①“操作1”和“操作2“的名称是________。②废液中加入过量锌粉的目的是______________________________,写出该步骤中任意一个反应的化学方程式______________________________________________________。③滤液1和滤液2含有相同的溶质,该溶质是________(填化学式)。过滤将硫酸铜、硫酸亚铁完全反应掉Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+FeZnSO44.人类的生产生活离不开金属材料。(1)铜和铁一样也可以生锈,铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],是铜与空气中的氧气、水和________(填化学式)共同作用的结果。(2)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中回收铜的过程如下:①向蓝色溶液中加入过量铁粉,发生反应的化学方程式是_________________________;②操作a是__________。Fe+CuSO4=FeSO4+CuCO2过滤5.金属和金属制品对人类社会的发展有着重要的作用。(1)钛及钛合金被称为“未来金属”,用其制造的潜艇、军舰没有磁性,不会被磁性水雷发现,这是利用钛的________(填“物理”或“化学”)性质。(2)钢铁是现代化生产中使用量最大的合金。《自然》杂志刊载“绿色炼铁”技术:电解熔融的氧化铁得到铁和氧气,该反应的化学方程式为_________________________。物理2Fe2O3(熔融)4Fe+3O2↑电解电解(3)把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后溶液呈浅绿色,向剩余固体中滴入稀盐酸,有气泡冒出。下列说法正确的是_____(填字母)。A.剩余固体肯定是银和铜B.反应后溶液中可能含有Ag+和Cu2+C.剩余固体可能含有铁,一定含有银和铜D.反应后溶液中的阳离子一定只有Fe2+D谢谢!
提供第六章-金属专项训练-2022-2023学年科粤版九年级化学-会员下载,编号:1701029562,格式为 xlsx,文件大小为39页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载