S同位素地球化学解析

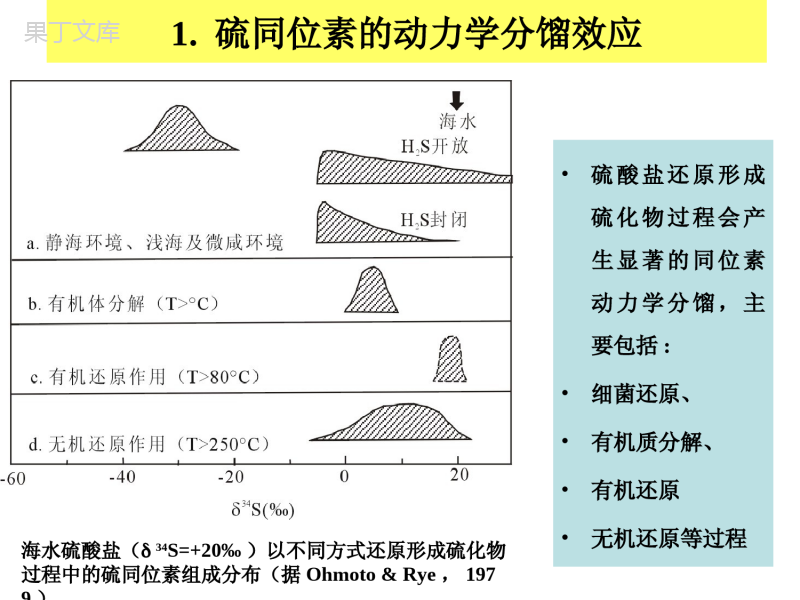

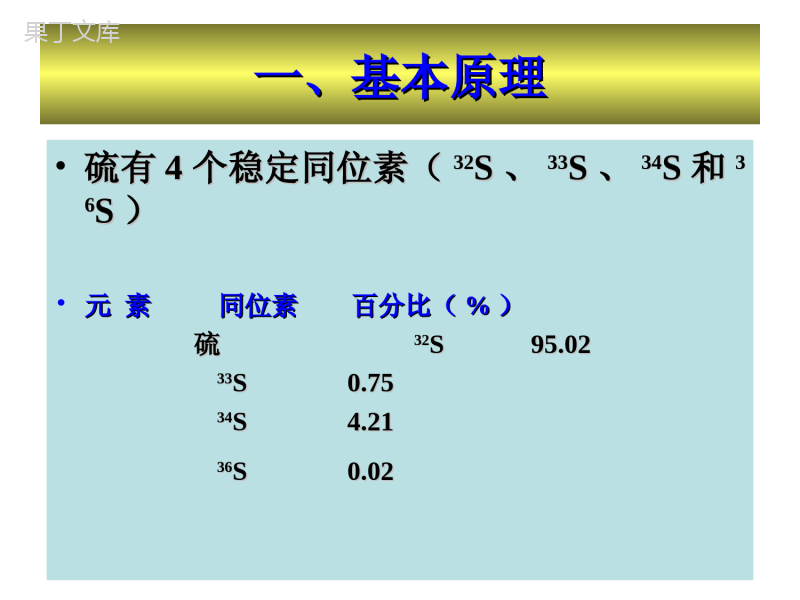

第四章、第四章、硫同位素地球化学硫同位素地球化学第一节、硫同位素组成和分馏第一节、硫同位素组成和分馏第二节、硫同位素在地质体中的分布第二节、硫同位素在地质体中的分布第三节、硫同位素地质应用第三节、硫同位素地质应用第一节、硫同位素组成和分馏第一节、硫同位素组成和分馏•一、基本原理一、基本原理•二、硫同位素的分馏二、硫同位素的分馏一、基本原理一、基本原理•硫有硫有44个稳定同位素(个稳定同位素(3232SS、、3333SS、、3434SS和和3366SS))•元素同位素百分比元素同位素百分比((%%))硫硫3232S95.02S95.023333S0.75S0.753434S4.21S4.213636S0.02S0.02•标准为迪亚布洛峡谷铁陨石中陨硫铁(标准为迪亚布洛峡谷铁陨石中陨硫铁(CDTCDT)。)。硫同位素组成表示为硫同位素组成表示为3434SS::•自然界中硫同位素的分馏十分大,34S值变化可达180‰。这与硫同位素的质量差和一系列化学性质有关。•硫是一种变价元素,在不同的氧化还原条件下,可形成负价的硫化物(-2价和-1价)、自然硫(0价)和正价的硫酸盐(+4价和+6价)。不同的含硫化合物之间由于价态的不同、化学键强度的强弱不同,会产生明显的硫同位素分馏效应。各种硫化物和硫酸盐的稳定性和溶解度各种硫化物和硫酸盐的稳定性和溶解度不同,如硫化物在低温水溶液中极难溶,不同,如硫化物在低温水溶液中极难溶,而硫酸盐的溶解度则相当大,造成富而硫酸盐的溶解度则相当大,造成富3434SS硫硫酸盐被溶解并带走,留下富酸盐被溶解并带走,留下富3232SS的硫化物,的硫化物,发生两者的机械分离。发生两者的机械分离。第一节、硫同位素组成和分馏第一节、硫同位素组成和分馏•一、基本原理一、基本原理•二、硫同位素的分馏二、硫同位素的分馏1、动力学分馏2、热力学平衡分馏二、硫同位素的分馏二、硫同位素的分馏1.硫同位素的动力学分馏效应•硫酸盐还原形成硫化物过程会产生显著的同位素动力学分馏,主要包括:•细菌还原、•有机质分解、•有机还原•无机还原等过程海水硫酸盐(34S=+20‰)以不同方式还原形成硫化物过程中的硫同位素组成分布(据Ohmoto&Rye,197硫酸盐的细菌还原是自然界中最重要的硫同位素分馏过程。这一过程十分复杂,可分为五个步骤进行:步骤反应式同位素分馏情况1细菌吸收硫酸盐伴有-2.8‰的动力学分馏2硫酸盐的有机结合:74OPAPSATP42SO2,即42SO与三磷酸腺苷(ATP)反应,形成五磷酸腺苷硫酸盐(APS)和焦磷酸盐。此步反应中,由于S-O键未破坏,基本上没有发生同位素分馏硫酸盐的细菌还原是自然界中最重要的硫同位素分馏过程。这一过程十分复杂,可分为五个步骤进行:步骤反应式同位素分馏情况3硫酸盐还原为亚硫酸盐:APS+H++Fe2+→32SO+AMP即APS与H+和Fe2+反应,还原形成32SO和单磷酸腺苷。当形成的亚硫酸盐还没有被迅速还原为H2S时,32SO与42SO之间可发生同位素交换平衡,25℃时,α=1.0244有机络合的亚硫酸盐还原成H2S:OHSHH32SO22有明显的动力学分馏K1/K2=1.025即形成的H2S可相对富32S达25‰5细菌释放出还原过程中形成的H2S硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。在对硫酸盐开放的环境中,如自然界的深海或静海环境,还原消耗掉的可从上覆海水中不断得到补充,使得同位素组成基本保持不变。此种环境下形成的硫化物具有相对稳定的34S值,K1/K2值为1.040~1.060,即硫化物的34S值比海水硫酸盐的低40‰~60‰(图6.5.1a)。硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。在硫酸盐组分的补给速度低于其还原速度的封闭、半封闭环境中,由于富32S的硫酸盐优先被还原成H2S,因此最初形成的硫化物的34S值最低。随着还原作用的进行,越是晚期形成的硫化物,34S值就越高。硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。对于H2S开放的体系,即生成的H2S迅速转变成金属硫化物而从体系中沉淀出来,则开始时硫化物的34S值很低,但晚阶段形成的硫化物的34S值可大于海水硫酸盐的初始值(~+20)硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。对于H2S封闭的体系,即生成的H2S未形成金属硫化物而离开体系,那么硫化物的34S值也是由低变高。在还原作用接近结束时,硫化物的值接近于海水硫酸盐的初始值。硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。•在温度>50℃时,含硫有机质受热分解,生成H2S,从而产生硫同位素动力分馏,K1/K2=1.015。•例如起始物质的34S值接近海水硫酸盐时(+20‰),则热分解形成的H2S的34S值为+5‰±5‰(图6.5.1b)。硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。随着温度升高,水溶硫酸盐可与有机物发生还原反应。如T~250:℃硫酸盐有机还原反应的速率一般较快,硫同位素分馏很小(图6.5.1c)。硫酸盐细菌还原过程产生的同位素分馏大小,与还原细菌的种类、还原反应速度及体系的开放与封闭程度等因素有关。在玄武岩与海水相互作用中,硫酸盐还原形成黄铁矿等硫化物。如:这一反应过程产生的同位素动力分馏K1/K2=1.000~1.025。即34S值为+20‰的海水与玄武岩反应生成的硫化物34S值为+20‰~-5‰(图6.5.1d)。•在热力学平衡状态下,不同价态的硫的同位素分馏具有如下特征:2.硫同位素的热力学平衡分馏第四章、第四章、硫同位素地球化学硫同位素地球化学第一节、硫同位素组成和分馏第一节、硫同位素组成和分馏第二节、硫同位素在地质体中的分布第二节、硫同位素在地质体中的分布第三节、硫同位素地质应用第三节、硫同位素地质应用第二节、不同地质储库的硫同位素组成一一..大气圈、水圈和生物圈的硫同位素组成大气圈、水圈和生物圈的硫同位素组成二二..地外物质的硫同位素组成地外物质的硫同位素组成三三..各类地球岩石的硫同位素组成各类地球岩石的硫同位素组成11火成岩火成岩22变质岩变质岩33沉积岩沉积岩44化石燃料化石燃料一一..大气圈、水圈和生物圈的硫同位素组大气圈、水圈和生物圈的硫同位素组成成大气中存在两种形式的硫:大气中存在两种形式的硫:气溶胶中硫酸盐气溶胶中硫酸盐气态的气态的HH22SS和和SOSO22。。大气中硫的来源有两种:大气中硫的来源有两种:11天然来源天然来源,如,如::火山喷发带来的火山喷发带来的SOSO22或或HH22SS((δδ3434S=-10‰S=-10‰~~+10‰+10‰););海水蒸发盐(海水蒸发盐(δδ3434S=+20‰S=+20‰););生物成因形成的生物成因形成的HH22SS或有机硫(或有机硫(δδ3434S=-30‰S=-30‰~~+10‰+10‰)。)。1.1.大气圈、水圈和生物圈的硫同位素组成大气圈、水圈和生物圈的硫同位素组成大气中硫的来源有两种:大气中硫的来源有两种:22人工污染源人工污染源,如,如::各种化石燃料燃烧后释放的各种化石燃料燃烧后释放的SOSO22((δδ3434S=-20‰S=-20‰~~+20+20‰‰););金属硫化物矿石冶冻产生的金属硫化物矿石冶冻产生的SOSO22((δδ3434S=-30‰S=-30‰~~+20+20‰‰););石膏加工的粉尘(石膏加工的粉尘(δδ3434S=+10‰S=+10‰~~+30‰+30‰)。)。一一..大气圈、水圈和生物圈的硫同位素组大气圈、水圈和生物圈的硫同位素组成成1.1.大气圈、水圈和生物圈的硫同位素组大气圈、水圈和生物圈的硫同位素组成成大气中硫同位素组成随物质来源的不同变化很大。大气中硫同位素组成随物质来源的不同变化很大。例如例如::在加拿大南部,大气在加拿大南部,大气δδ3434SS值冬天高,夏天值冬天高,夏天低。其原因是冬天大气中硫的来源以化石燃烧和工低。其原因是冬天大气中硫的来源以化石燃烧和工业源为主,而夏天有大量富业源为主,而夏天有大量富3232SS的生物成因硫从土的生物成因硫从土壤、植被、沼泽、湖泊和湿土中释放进入大气。壤、植被、沼泽、湖泊和湿土中释放进入大气。一一..大气圈、水圈和生物圈的硫同位素组大气圈、水圈和生物圈的硫同位素组成成1.1.大气圈、水圈和生物圈的硫同位素组成大气圈、水圈和生物圈的硫同位素组成生物体中的硫主要赋存于蛋白质中。生物体中的硫主要赋存于蛋白质中。生物体通过同化硫酸盐还原作用来合成有机生物体通过同化硫酸盐还原作用来合成有机硫化合物。无论是淡水中植物还是海洋中生硫化合物。无论是淡水中植物还是海洋中生物,其物,其δδ3434SS值均比水中溶解硫酸盐的低一值均比水中溶解硫酸盐的低一些。这是因为在生物体内硫酸盐还原过程存些。这是因为在生物体内硫酸盐还原过程存在在在在+0.5‰+0.5‰~~-4.5‰-4.5‰的同位素分馏。的同位素分馏。一一..大气圈、水圈和生物圈的硫同位素组大气圈、水圈和生物圈的硫同位素组成成1.1.大气圈、水圈和生物圈的硫同位素组成大气圈、水圈和生物圈的硫同位素组成水圈中发生的氧化与还原过程相当复杂。水圈中发生的氧化与还原过程相当复杂。水体中溶解硫酸盐被细菌还原成水体中溶解硫酸盐被细菌还原成HH22SS,,3434SS值值可降低可降低0~50‰0~50‰。如果反复还原—氧化—还原,则。如果反复还原—氧化—还原,则可能形成十分贫可能形成十分贫3434SS的的HH22SS,,如如::捷克某地地下水中捷克某地地下水中SS2-2-的的3434SS值为值为-62‰-62‰。加拿大西部。加拿大西部某泉水中水溶的某泉水中水溶的3434SS值为值为+25‰+25‰,而与藻类伴生的氧化菌,而与藻类伴生的氧化菌把贫把贫3434SS的的HSHS--氧化,使产物的氧化,使产物的3434SS值为值为0‰0‰。。一一..大气圈、水圈和生物圈的硫同位素组大气圈、水圈和生物圈的硫同位素组成成二二..地外物质的硫同位素组成地外物质的硫同位素组成•各类陨石的硫含量不同。铁陨石最富硫,其次是球粒陨石,无各类陨石的硫含量不同。铁陨石最富硫,其次是球粒陨石,无球粒陨石硫含量最低。球粒陨石硫含量最低。•铁陨石的硫同位素组成变化极小,铁陨石的硫同位素组成变化极小,δδ3434SS值为值为0.0‰0.0‰~~+0.6+0.6‰‰。。•碳质球粒陨石全岩硫碳质球粒陨石全岩硫δδ3434SS值接近于铁陨石,为值接近于铁陨石,为+0.4‰+0.4‰,但,但不同含硫相间存在明显的硫同位素分馏,不同含硫相间存在明显的硫同位素分馏,–硫酸盐硫酸盐δδ3434SS值为值为-1.3‰-1.3‰~~-1.6‰-1.6‰,,–元素硫元素硫δδ3434SS值为值为+1.5‰+1.5‰~~+1.8‰+1.8‰,,–而硫化物(而硫化物(FeSFeS))δδ3434SS值为值为+2.6‰+2.6‰~~+3.0‰+3.0‰。。2.2.地外物质的硫同位素组成地外物质的硫同位素组成碳质球粒陨石不同含硫相间存在明显的硫同位素分馏,碳质球粒陨石不同含硫相间存在明显的硫同位素分馏,硫酸盐硫酸盐δδ3434SS值为值为-1.3‰-1.3‰~~-1.6‰-1.6‰,,元素硫元素硫δδ3434SS值为值为+1.5‰+1.5‰~~+1.8‰+1.8‰,,而硫化物(而硫化物(FeSFeS))δδ3434SS值为值为+2.6‰+2.6‰~~+3.0‰+3.0‰。。这种硫酸盐比硫化物更富这种硫酸盐比硫化物更富3232SS的现象与地球上的硫同位素的现象与地球上的硫同位素分馏刚好相反。这是因为在陨石中硫酸盐是通过硫与水的氧化分馏刚好相反。这是因为在陨石中硫酸盐是通过硫与水的氧化反应形成的,动力学分馏效应使氧化产物富反应形成的,动力学分馏效应使氧化产物富3232S(MonsteretS(Monsteretal.,1965)al.,1965)。。二二..地外物质的硫同位素组成地外物质的硫同位素组成2.2.地外物质的硫同位素组成地外物质的硫同位素组成月球岩石中,硫主要以硫化铁(月球岩石中,硫主要以硫化铁(FeSFeS)形式存在。)形式存在。月球玄武岩的月球玄武岩的3434SS值为值为-0.2‰~+1.3‰-0.2‰~+1.3‰;;角砾岩的角砾岩的3434SS值稍高,为值稍高,为+3.3‰~+3.6‰+3.3‰~+3.6‰;;而月壤的而月壤的3434SS值最高,为值最高,为+4.4‰~+8.8‰+4.4‰~+8.8‰。。对于从玄武岩→角砾岩→月壤对于从玄武岩→角砾岩→月壤3434SS富集的趋势,目前还无很有富集的趋势,目前还无很有说服力的解释。一种理论认为,在太阳风的影响下,粒子轰击说服力的解释。一种理论认为,在太阳风的影响下,粒子轰击使使3232SS以以HH22SS形式逸失形式逸失(DesMarais,1983)(DesMarais,1983)。。二二..地外物质的硫同位素组成地外物质的硫同位素组成三三..各类地球岩石的硫同位素组成各类地球岩石的硫同位素组成1火成岩基性—超基性岩石的34S值与陨石硫十分相近,变化范围很小,为±1‰。由于地壳硫的混染作用、海水蚀变作用或岩浆去气作用的影响,有些基性—超基性岩石也可能呈现较大的硫同位素组成变化(>10‰)。11火成岩火成岩花岗岩和伟晶岩的34S值为-13.4‰~+28.7‰。磁铁矿系列花岗岩34S一般为正值(+1‰~+9‰),高于钛铁矿系列花岗岩的34S值(-11‰~1‰)。11火成岩火成岩中酸性火山喷出岩的34S值变化比相应深成岩大,且一般34S为正值,其硫同位素组成变化与火山气中H2S和SO2的去气作用及火山喷发时海水硫的混染作用等因素有关。22变质岩变质岩•变质岩的硫同位素组成与变质岩原岩、变质作用过程中的水—岩反应和同位素交换、和变质脱气作用等因素有关。大多数变质岩的34S值变化为-20‰~+20‰。•某地遭受区域变质的含硫化物石墨片岩的34S值为-27‰,说明它们仍保留了富有机质沉积原岩的硫同位素特征。•在温度>500℃的变质岩中,共生的黄铁矿—磁黄铁矿可在毫米级至厘米级范围内达到新的同位素平衡,反映真实的变质温度。33沉积岩沉积岩•海洋沉积物中硫化物的34S值通常比海水硫酸盐低20‰~60‰。•现代大洋沉积物中黄铁矿34S值平均变化范围为-20‰~-10‰。个别样品34S值可低至-50‰以下或者高达+20‰以上。33沉积岩沉积岩•沉积物中的硫有多种不同存在形式,如黄铁矿、酸挥发性硫化物(Acid-VolatileSulfide),干酪根、沥青、硫酸盐和元素硫。•相对于海水硫酸盐,黄铁矿通常是最贫34S的。而酸挥发性硫化物和干酪根中硫的34S值稍高于黄铁矿。元素硫主要赋存在表层沉积物中,很可能是通过沉积物—水界面扩散上来的硫化氢氧化的结果。33沉积岩沉积岩•海洋沉积物中黄铁矿主要是通过细菌还原海水硫酸盐形成的,反应式如下:••因此,沉积物中黄铁矿的量受硫酸根离子浓度、有机质含量、孔隙水中Fe2+离子含量等因素控制。33沉积岩沉积岩•沉积岩中硫同位素的分布主要受氧化还原作用所控制1.氧化过程中引起的硫同位素分馏不明显。2.还原作用,特别是细菌还原作用引起的硫同位素组成分馏明显。沉积旋回中,硫化物和硫酸盐的分馏特征:1.20亿年前的太古代和早元古代岩石中硫化物硫和硫酸盐都具有相同的、接近于陨石硫值的同位素组成。这表明在没有生物作用参与的情况下,地幔来源物质经风化、搬运、沉积而转变为沉积岩的过程中,含硫化合物之间的硫同位素组成没有产生明显的差异;2.在20亿年以后形成的沉积岩中,由于出现硫酸盐还原细菌,含硫化合物间的硫同位素组成发生明显的变化。•现代海水硫酸盐的34S值为+20‰。地质历史时期,海水硫酸盐的34S值是变化的(图6.5.1)。前寒武纪海水34S值为+16‰~+18‰,到寒武纪时达到+30‰以上。•现代海水硫酸盐的34S值为+20‰。地质历史时期,海水硫酸盐的34S值是变化的(图6.5.1)。在泥盆纪34S又跃升至约+25‰。从寒武纪到志留纪,34S值逐渐下降至+16‰。•现代海水硫酸盐的34S值为+20‰。地质历史时期,海水硫酸盐的34S值是变化的(图6.5.1)。从三叠纪开始,34S值逐渐上升,达到现代的+20‰左右(图6.5.2)。之后又逐渐下降至约+10‰。在泥盆纪34S又跃升至约+25‰。从寒武纪到志留纪,34S值逐渐下降至+16‰。•不同地质时期形成的石油,34S值变化很大(-21‰~+28‰)。•但同一储油层中相同时代形成的石油,34S值变化则很小。例如,伊拉克白垩系地层中石油34S值为-6.2‰~+1.2‰,而三叠系地层中石油34S值为+2.3‰(Thode&Rees,1970)。44化石燃料化石燃料•天然气中大多含有一定量的H2S,其成因有生物成因、热化学成因和岩浆成因三种,以细菌还原硫酸盐的生物成因H2S占主导地位。•天然气中H2S的硫同位素组成与其生成地质时代的海相地层硫酸盐的34S值有关。同时代气藏H2S的34S值十分接近(变化一般在5‰以内),但不同时代气藏,如四川盆地二叠系与三叠系气藏H2S的34S值可相差>10‰。44化石燃料化石燃料•煤中的硫主要以有机硫和硫化物硫两种形式存在。•煤中有机硫有两个来源,一是植物中的原始有机硫,二是成煤过程中与有机质反应的生物成因硫化物。•一般而言,低硫煤中有机硫的34S值较均一,而高硫煤中有机硫的34S值变化较大,且富集32S。例如,美国依利诺伊盆地中石炭系地层中煤,有机硫含量>0.8%时,34S值为-8‰~+15‰;有机硫含量<0.8%时,34S值为+5~+13‰(Thode,1991)。3.4化石燃料44化石燃料化石燃料第四章、第四章、硫同位素地球化学硫同位素地球化学第一节、硫同位素组成和分馏第一节、硫同位素组成和分馏第二节、硫同位素在地质体中的分布第二节、硫同位素在地质体中的分布第三节、硫同位素地质应用第三节、硫同位素地质应用一.硫同位素在火成岩岩石成因研究中的应用二.热液矿床的硫同位素组成与成矿的物理化学环境三.硫同位素地层学第三节、硫同位素地质应用第三节、硫同位素地质应用一一..硫同位素在火成岩岩石成因研究中的应硫同位素在火成岩岩石成因研究中的应用用•岩浆中硫的存在形式主要有三种:硫化物、硫酸盐和挥发分硫(SO2、H2S等)。岩浆上升过程中的去气作用会产生硫同位素的分馏,化学反应式为:1.1.硫同位素在火成岩岩石成因研究中的应用硫同位素在火成岩岩石成因研究中的应用•根据质量守恒原理,熔体和气体的硫同位素组成为:•式中X为熔体中硫化物硫相对于硫酸盐硫的摩尔分数,Y为岩浆挥发份中SO2硫相对于H2S硫的摩尔分数。一一..硫同位素在火成岩岩石成因研究中的应硫同位素在火成岩岩石成因研究中的应用用1.1.硫同位素在火成岩岩石成因研究中的应用硫同位素在火成岩岩石成因研究中的应用•岩浆去气导致不同比例的硫丢失,其结果使熔体内硫化物和硫酸盐的硫同位素组成发生变化,这一过程可用瑞利分馏模型来模拟。一一..硫同位素在火成岩岩石成因研究中的应硫同位素在火成岩岩石成因研究中的应用用•图6.5.3表示SO2或H2S去气作用对熔体中硫化物和硫酸盐34S值的影响。•SO2的去气能引起熔体亏损34S,而H2S的去气能使熔体富集34S,•亏损或富集的程度与熔质中硫化物相对于硫酸盐的摩尔分数(X)和残留在熔体中硫的分数F有关。1.1.硫同位素在火成岩岩石成因研究中的应用硫同位素在火成岩岩石成因研究中的应用•在Kilauea火山岩区,喷发到陆地上的火山岩与海底熔岩的硫同位素组成明显不同,其原因很可能就是由于SO2的去气作用(Sakaietal.,1982)。•海底玄武岩34S值为+0.7‰,硫酸盐/硫化物比值高;而大陆玄武岩含硫量低,34S值低(-0.8‰),硫酸盐/硫化物比值也低,这些特征均说明大陆玄武岩经历了SO2的快速去气作用。一一..硫同位素在火成岩岩石成因研究中的应用硫同位素在火成岩岩石成因研究中的应用1.1.硫同位素在火成岩岩石成因研究中的应用硫同位素在火成岩岩石成因研究中的应用对金伯利岩中金刚石包裹体中硫化物的硫同位素分析发现:•橄榄岩组合型金刚石34S值接近于0‰,变化小;•而榴辉岩组合型金刚石34S值变化大,为-11‰~+14‰,•这可能与俯冲到地幔的地壳物质有关(Eldridgeetal.,1991)。一一..硫同位素在火成岩岩石成因研究中的应硫同位素在火成岩岩石成因研究中的应用用二二..热液矿床的硫同位素组成与成矿的热液矿床的硫同位素组成与成矿的物理化学环境物理化学环境•热液矿床中含硫矿物的硫同位素组成不但与成矿溶液的硫同位素组成及成矿温度有关,而且与成矿溶液的pH和fo2有关,并受矿物形成时体系的开放或封闭性质所控制。•在封闭体系条件下,含硫矿物的沉淀导致成矿溶液中溶解硫含量降低,发生储库同位素效应。2.热液矿床的硫同位素组成与成矿的物理化学环境•在高温(T>400℃)条件下,热液体系中硫主要为H2S和sO2。热液全硫(∑S)的34S值可表示为:34S∑s=34SH2SXH2S+34SSO2XSO2•式中XH2S和XSO2分别是热液中H2S和SO2相对于总硫的摩尔分数。二二..热液矿床的硫同位素组成与成矿的热液矿床的硫同位素组成与成矿的物理化学环境物理化学环境2.热液矿床的硫同位素组成与成矿的物理化学环境•在中低温(T<350℃)条件下,热液体系中硫以硫酸盐和H2S为主,其同位素组成可表示为:二二..热液矿床的硫同位素组成与成矿的热液矿床的硫同位素组成与成矿的物理化学环境物理化学环境从图可知,在高fo2条件下形成的硫化物比热液的34S值要小很多。只有在低fo2和低pH条件下,硫化物的34S值才与热液的34S值相近。250℃平衡条件下热液硫同位素组成与成矿物理化学条件(fo2,pH)关系图Ohmoto(1972)总结了热液体系中矿物沉淀的化学环境与热液矿物的硫和碳同位素组成的关系三.硫同位素地层学•类似于氧、碳同位素地层学,硫同位素地层学在研究地质历史时期一些重要的地层界线事件中发挥了重要作用。日本Kawaruppu剖面白垩系—第三系界线处沉积岩中黄铁矿的34S值在白垩系Maastrichtian组中为-38.4‰~-20.2‰,平均为-30.8‰;在界线粘土层中34S值明显偏正,为-13.9‰~-2.0‰,平均为-7.5‰;在粘土层之上的第三系Danian组中34S值为-28.4‰~+0.3‰,平均为-18.1‰。三.硫同位素地层学前寒武系—寒武系界线处,沉积岩中黄铁矿的34S值也呈现跳跃式变化特征。例如在波兰的东欧地台上,前寒武系—寒武系界线附近34S值变化为+4‰~+47‰。前寒武系地层中34S值平均为+32.6‰,明显高于寒武系地层(平均34S=+23.3‰)。
提供S同位素地球化学解析会员下载,编号:1701027001,格式为 xlsx,文件大小为61页,请使用软件:wps,office Excel 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。
